Principy imunoanalytických metod
Neizotopové metody
Enzymová imunoanalýza
Enzymová imunoanalýza (EIA) využívá jako indikátor enzym. Enzym je chemicky (kovalentně) vázán buď na antigen, nebo protilátku – vznikne enzymový konjugát . Uspořádání je možné jak kompetitivní, tak nekompetitivní. Enzym katalyzuje chemickou přeměnu substrátu, který je přidán do reakční směsi, na produkt, který je barevný. Stanovuje se pak spektrofotometricky (viz chromogenní substrát), nebo na základě fluorescence (fluorimetrické stanovení). Koncentrace produktu je úměrná koncentraci antigenu nebo protilátky ve vzorku.
Heterogenní enzymové imunoanalýzy
Po proběhnutí imunochemické reakce (inkubaci) je z reakční směsi obvykle odstraněna volná frakce indikátoru většinou s využitím pevné fáze. Následuje přídavek enzymového substrátu a po pevně určené době je reakce mezi enzymem a substrátem zastavena (např. přidáním "stop" činidla) a spektrofotometricky je měřeno zeslabení monochromatického světla roztokem. Pomocí kalibrační křivky lze poté odečítat koncentrace analyzovaných vzorků.
Nejznámější heterogenní enzymovou imunoanalýzou je ELISA (Enzyme-Linked ImmunoSorbent Assai). Existuje mnoho variant této metody, společným znakem je zakotvení (adsorpce nebo kovalentní navázání) antigenu nebo protilátky na nerozpustný nosič (často povrch reakční nádobky nebo mikrotitrační destičky), což usnadňuje separaci imunochemicky navázaných molekul.
Na Obrázcích 13 a 14 jsou schematicky znázorněny metody ELISA: nekompetitivní sendvičová, nejčastěji používaná pro stanovené antigenů s více než jednou antigenní determinantou, a capture ELISA pro stanovení protilátek.
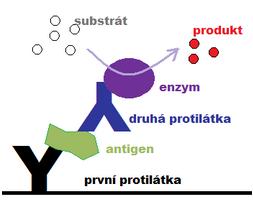
Obrázek 13 Schéma sendvičové ELISA pro detekci antigenů (zdroj: www.wikiskripta.eu)
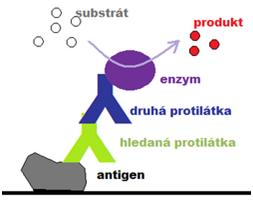
Obrázek 14 Schéma capture ELISA pro detekci protilátek (zdroj: www.wikiskripta.eu)
Homogenní enzymové imunoanalýzy
Využívají efekty, při kterých dochází ke změně aktivity enzymu v imunokomplexu. Příkladem může být stínění aktivního místa enzymu - situace, kdy je vlivem stérických podmínek během imunochemické reakce ovlivněna aktivita enzymového konjugátu a tím i rychlost přeměny enzymového substrátu na produkt. Vzorek obsahující stanovovanou látku je v reakční směsi smíchán s indikátorem, kterým je konjugát vhodného enzymu se stanovovaným antigenem. V kompetitivní reakci pak spolu oba soutěží o limitované množství vazebných míst protilátky. Část enzymového konjugátu zůstává volná (její množství je závislé na množství stanovované látky v analyzovaném vzorku) a může tak reagovat se substrátem. Frakce konjugátu navázaná na protilátku pak, vzhledem k zastínění aktivního centra enzymu, enzymovou aktivitu nevykazuje (Obrázek 15).
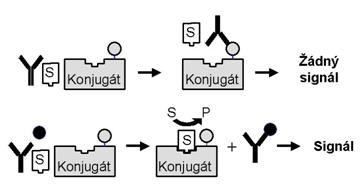
Obrázek 15. Homogenní enzymová imunoanalýza - stínění aktivního místa enzymu. S = substrát, P = produkt
Enzymová aktivita je tedy tím vyšší, čím větší je množství stanovovaného antigenu v analyzovaném vzorku, protože na protilátku se ho naváže více a naopak v nenavázané formě zůstane více enzymového konjugátu. Enzymová aktivita v reakční směsi je tedy přímo úměrná množství analyzovaného antigenu.
Z hlediska provedení jsou homogenní EIA jednoduché, avšak mnohem méně citlivé než metody heterogenní. Užívají se ke stanovení nízkomolekulárních látek (léků, hormonů a metabolitů). Příkladem je metoda CEDIA (Cloned Enzyme Donor Immunoassay) nebo EMIT (Enzyme Multiplied Immunoassay Technique), využívané např. v toxikologii.
Enzymové konjugáty
Klíčovým problémem EIA je právě příprava vhodných enzymových konjugátů, tedy látek, kde je enzym chemicky vázán na stanovovaný antigen nebo protilátku. Základní podmínkou úspěšné EIA je rovněž výběr vhodného enzymu, který musí splňovat řadu obecných podmínek:
- musí mít vysoké číslo přeměny,
- aktivita enzymu musí být přesně a snadno měřitelná
- enzym musí zachovávat enzymovou aktivitu po vazbě na antigen nebo protilátku (heterogenní EIA), nebo enzymová aktivita musí být výrazně modulována vazbou konjugátu na protilátku (homogenní EIA)
- enzym musí být snadno dostupný
- enzym se nesmí vyskytovat v tělní tekutině, ve které je prováděno vyšetření
U homogenních EIA se jako enzymy používají například glukozo-6-fosfátdehydrogenáza nebo malátdehydrogenáza. Nejčastěji používanými enzymy v heterogenní EIA jsou křenová peroxidáza nebo alkalická fosfatáza.
Jak fungují enzymy v EIA
Křenová peroxidáza katalyzuje reakci peroxidu vodíku s vhodným substrátem, který se oxiduje na barevný produkt. Substráty jsou například TMB (3,3',5,5' tetramethylbenzidin), ABTS (2,2' azino-bis-(3-etylbenzthiazolin-6-sulfonát) nebo OPD (o-fenylendiamin).
Alkalická fosfatáza v enzymatické reakci štěpí esterickou vazbu kyseliny fosforečné (např. štěpí bezbarvý para-nitrofenylfosfát na žlutý para-nitrofenol, fotometrická detekce při 420 nm). Štěpením umbelliferylfosfátu vzniká umbelliferon, který fluoreskuje a dá se měřit fluorometricky.
Detekce enzymatických imunoanalýz
Kolorimetrická (fotometrická) detekce je nejrozšířenější typ detekce u klasických enzymoimunoanalýz. Principem detekce je zeslabení intenzity světelného toku monochromatického světla zbarveným roztokem produktu enzymatické reakce. Přístroje pro měření absorbance se nazývají spektrofotometry.
Nefelometrická detekce využívá enzym lysozym a jako substrát peptidoglykany. Jako substrátu bylo využito fragmentů buněčných stěn bakterií Micrococcus luteus. Paprsek monochromatického světla (např. laserového zdroje) je rozptylován v zakaleném roztoku částic. Míra rozptylu světla je úměrná množství částic, tedy aktivitě enzymu. Moderní nefelometry jsou vybaveny laserovými zdroji přísně monochromatického světla, což zjednodušuje další konstrukci přístrojů.
Fluorometrická detekce umožňuje dosažení vyšší citlivosti při použití stejného enzymu.
Tento nebo obdobný princip detekce je využíván v celé řadě analytických systémů, například technologie MEIA (Microparticle Enzyme Immunoassay) na analyzátorech IMx a AxSYM firmy Abbott (Obrázek 16).

Obrázek 16. Přístroj AxSYM (Abbott Laboratories..)
Luminometrická detekce využívá efektu bioluminiscence, spojené s enzymatickou reakcí. V tomto případě se však jedná o chemiluminiscenci, kdy je světelné záření produkováno během enzymatické reakce. V praxi jsou pro tyto účely nejpoužívanějšími enzymy alkalická fosfatáza a křenová peroxidáza. Tento princip je využíván například u analyzátorů řady IMMULITE firmy DPC nebo analyzátorů Access firmy Beckman – Coulter (Obrázek 17).

Obrázek 17. Přístroj Access (Beckman Coulter.
Při použití enzymu křenové peroxidázy, dochází v přítomnosti peroxidu vodíku k oxidaci luminolu. Při reakci je však produkce světelného záření slabá. Byla ale objevena řada látek (luciferin, benzthiazoly,...), které zesilují a prodlužují produkci světelných kvant této oxidační reakce. Reakce dává s použitím těchto zesilovačů kontinuální výstup světelného signálu, který může být měřen i s časovým odstupem. Tyto metody jsou pak označovány jako zesílená chemiluminiscence, "enhanced chemiluminescence". Tento systém byl propracován firmou Amersahm a byl dodáván na trh pod označením Amerlite. Nyní tento princip využívá analyzátor Vitros ECi firmy Ortho-Clinical Diagnostics (Obrázek 18).

Obrázek 18. Vitros ECi (Ortho-Clinical Diagnostics)