Zvláštnosti laboratorního vyšetřování v dětském věku a ve stáří
| Stránky: | POSTUDIUM |
| Kurz: | Laboratorní vyšetření v dětském věku a u seniorů |
| Kniha: | Zvláštnosti laboratorního vyšetřování v dětském věku a ve stáří |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | sobota, 20. dubna 2024, 02.47 |
V určitém věkovém období má laboratorní vyšetření svá specifika, kterými se odlišuje od nejčastěji hodnocených výsledků osob středního věku. V dětském věku, nejvýrazněji u novorozenců, pozorujeme nezralost celé řady metabolických drah, ve stáří pak dochází k postupné involuci orgánů a nejvíc je metabolismus ovlivněn mnohými chorobami a léky, které senioři užívají. V následujících odstavcích budou shrnuty změny a zvláštnosti typické pro obě skupiny.
Dětský věk s sebou přináší řadu odlišností i při laboratorním vyšetřování; toto platí samozřejmě hlavně pro novorozence a kojence. Odlišnosti se týkají jak způsobu odběru biologického materiálu, zejména krve, tak výsledků laboratorních vyšetření – u zdravých i při nemoci. Míra těchto odlišností je dána gestačním věkem a porodní hmotností novorozence (Tabulka 1).
Tabulka 1. Obvykle užívané termíny při klasifikaci novorozenců
|
Podle gestačního věku |
zralý |
37. – 42. týden gestace |
|
|
nezralý |
< 37. týden gestace |
|
|
extrémně nezralý |
< 30. týden gestace |
|
Podle porodní hmotnosti |
nízká |
< 2,5 kg |
|
|
velmi nízká |
< 1,5 kg |
|
|
extrémně nízká |
< 1,0 kg |
|
Další klasifikace |
malý vzhledem ke gestačnímu věku | |
|
|
úměrný gestačnímu věku | |
|
|
velký vzhledem ke gestačnímu věku | |
Odběr krve je u novorozenců obtížný; přitom zvláště u nedonošených a dětí s nízkou porodní hmotností je potřebná intenzivní péče, která vyžaduje časté laboratorní kontroly. Je třeba získat množství krve dostatečné k provedení všech indikovaných laboratorních testů. Nesmírný význam zde má úzká spolupráce pediatra s laboratoří: personál provádějící odběr musí vědět, jaký objem krve stačí pro určité testy, a v laboratoři je zase třeba provádět testy z minimálního objemu krve a v pořadí podle jejich nezbytnosti pro určení diagnózy a řízení další léčby.
U novorozenců, zejména nedonošených, je nutné pokud možno vystačit s krví získanou kožním vpichem do patičky dítěte. Tato krev tvoří směs získanou z arteriol, kapilár i venul. Velmi důležité je zvolit správné místo vpichu. Vhodné jsou pouze postranní části, vpich uprostřed patičky je zakázaný vzhledem k nebezpečí poranění patní kosti s možností následné nekrotizující osteochondritidy či dokonce osteomyelitidy (Obrázek 1).
Obrázek 1. Znázornění vhodného a zakázaného místa vpichu při odběru krve z patičky
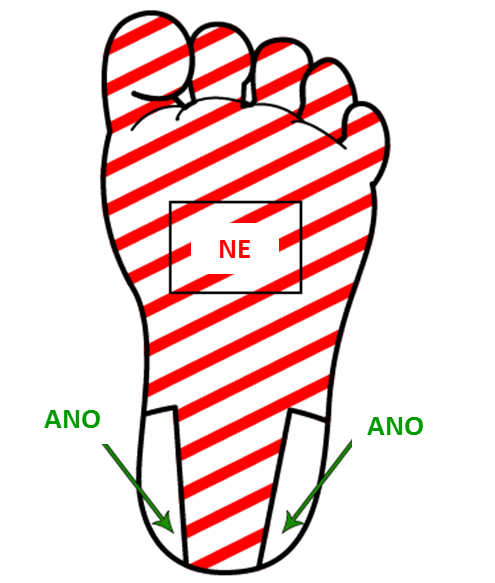
Z téhož důvodu by se neměla užívat lanceta delší než 2,4 mm. Nožka dítěte se přitom nesmí zvedat, aby byl zachován dostatečný hydrostatický tlak v cévách. Musíme se vyhnout nadměrného »ždímání« krve, které vede k naředění krve tkáňovým mokem a zkreslení mnohých výsledků.
U větších dětí se preferuje odběr kapilární krve z prstu ruky. I zde je třeba provést vpich do laterální strany bříška prstu: je méně bolestivý a nehrozí zatékání krve pod nehet.
Větší množství krve získáváme žilním odběrem. U malých dětí volíme kteroukoli viditelnou žílu, nejčastěji na hlavičce, u větších dětí žílu kubitální. Je třeba mít neustále na mysli, že jakýkoli odběr krve znamená pro dítě stres, i když to u nejmenších novorozenců nemusí být zřetelně vidět. Opakované nešetrné odběry tak mohou nebezpečně zhoršit stav kriticky nemocného dítěte. Lhostejný není ani objem odebrané krve. Jestliže je krevní objem u novorozence přibližně 80 ml/kg, představuje odběr 8 ml krve u dítěte o hmotnosti 1 kg ztrátu 10 % krve! Z toho plyne nezbytnost užití mikrometod při zpracování vzorků krve dětí.
Jak personál provádějící odběr, tak pracovníci laboratoří musí zacházet s krví co nejšetrněji, neboť krvinky novorozence jsou fragilnější než v pozdějším věku a větší stupeň hemolýzy může zcela znehodnotit výsledky mnohých testů (kalium, LD aj.).
Vyžaduje-li laboratorní vyšetření přídavek určitého činidla ke krvi (např. antikoagulačního), je třeba dodržet optimální poměr mezi množstvím tohoto přídavku a objemem odebrané krve, který je mnohdy velmi malý.
U dospělých se většina biochemických testů provádí ze séra. U novorozenců musíme počítat s vysokým hematokritem (i přes 60 %), a tedy i ziskem menšího množství séra. Užití plazmy bývá šetrnější ke krvinkám a hemolýza je méně častá. Kromě takových testů, jako je glykémie, vyšetření krevního obrazu či acidobazické rovnováhy, existuje v poslední době možnost provádět i četná další stanovení z plné krve (minerály, laktát, močovina aj.). Jedná se vesměs o metody s elektrochemickou detekcí (iontově selektivní a enzymové elektrody), kde nevadí barva krve jako u metod spektrofotometrických. Kratší a šetrnější manipulace v tomto případě má za následek méně častou hemolýzu; když k ní však přesto dojde, nepoznáme ji. Laboratoř si musí být dále vědoma toho, že u malého objemu vzorku, je-li skladován v otevřené nádobce, může odpařování vody vést poměrně rychle k významnému zahuštění, a tím ke zkreslení výsledků.
Při hodnocení výsledků musíme vědět, zda byla odebrána krev kapilární nebo venózní – některé analyty zde totiž mají odlišnou koncentraci (např. glukóza).
Obtížnost odběru krve vede k užívání neinvazivních transkutánních metod. Oxygenace krve se dá transkutánně posuzovat pulsní oxymetrií. Opakované odběry krve pro stanovení koncentrace bilirubinu nejsou nutné při užití transkutánního bilirubinometru.
I odběr moči má své zvláštnosti. Pro obtížnost časového sběru obvykle vystačíme s jednorázovým vzorkem. Aby se odstranil vliv rozdílného zahuštění moči na výsledek, vztahuje se měřená hodnota k množství kreatininu v témže vzorku moči. Provádíme-li přesto sběr moči, je třeba při její konzervaci užít objem činidla, který odpovídá očekávané diuréze pro dané věkové období.
Metabolismus novorozenců a zčásti i menších dětí je v určitém ohledu odlišný od metabolismu dospělého. To např. způsobuje, že řada laboratorních metod má u novorozenců odlišné referenční hodnoty. Bez jejich znalosti nelze správně výsledek zhodnotit. Referenční hodnoty jsou však výrazně ovlivněny nejen věkem novorozence, ale liší se i podle stupně zralosti a porodní hmotnosti. Není tedy divu, že mnohdy nejsou exaktně známé – shromáždění dostatečného počtu výsledků od zdravých novorozenců stejného stupně zralosti, stejné věkové kategorie i porodní hmotnosti je velmi obtížné. Jak bude dále uvedeno, některé metabolické odlišnosti se mohou projevit až za nemoci, při přetížení určitého orgánu.
Voda tvoří u novorozence 70 – 75 % tělesné hmotnosti (u dospělého 55 – 60 %). Je to způsobeno zvětšeným objemem extracelulární tekutiny, která tvoří u novorozence téměř 40 %, u dospělého 20 % tělesné hmotnosti. Během prvních týdnů života dochází ke kontrakci extracelulárního prostoru, což má za následek pokles tělesné hmotnosti u donošených novorozenců o 5 – 10 %, u nedonošených dokonce o 10 – 20 %.
Vztáhneme-li obrat tělesné vody k objemu extracelulárního prostoru, najdeme velké rozdíly mezi kojencem a dospělým. Tělo dospělého člověka o hmotnosti 70 kg obsahuje přibližně 14 kg (litrů) extracelulární tekutiny (ECT); denní obrat vody (množství ztracené močí a extrarenálně, a tedy i hrazené v potravě) je přibližně 2 litry, tj. sedmina objemu ECT. Naproti tomu u desetiměsíčního kojence o hmotnosti 7 kg a objemu ECT 1,4 l znamená fyziologická diuréza 700 ml polovinu ECT! To je důvod, proč udržování hydratace je u kojenců značně labilnější a při nečekaných ztrátách tekutin (zvracení, průjmy) rychle dochází k těžké dehydrataci.
Obsah tuku v těle novorozence je výrazně menší než u dospělého a navíc závisí na gestačním věku. Tak novorozenec narozený v 28. týdnu těhotenství má jen 3,5 % tělesného tuku, zatímco u donošeného novorozence je to asi 15 %.
Koncentrace některých parametrů v době narození odpovídá koncentraci v krvi matky, jiné se liší a odrážejí vlastní biochemický profil novorozence. Tak hladina plazmatického vápníku roste s gestačním věkem a v době porodu je dokonce vyšší než u matky. Pak dochází k poklesu s minimem 24 – 48 h po porodu způsobenému nezralostí příštítných tělísek. Později hladina vápníku opět stoupá tak, jak je aktivována tvorba parathormonu.
Plazmatické bílkoviny nepronikají placentou a jejich hladina je dána stavem intrauterinní výživy a zralostí novorozence. Výjimku tvoří IgG, jehož přenos z těla matky placentou je možný. Nejnižší hladinu imunoglobulinů nacházíme asi 3 měsíce po porodu, pak jejich koncentrace až do dospělosti plynule stoupá (Obrázek 2).
Obrázek 2. Změny koncentrace imunoglobulinů ve fetálním a postnatálním období
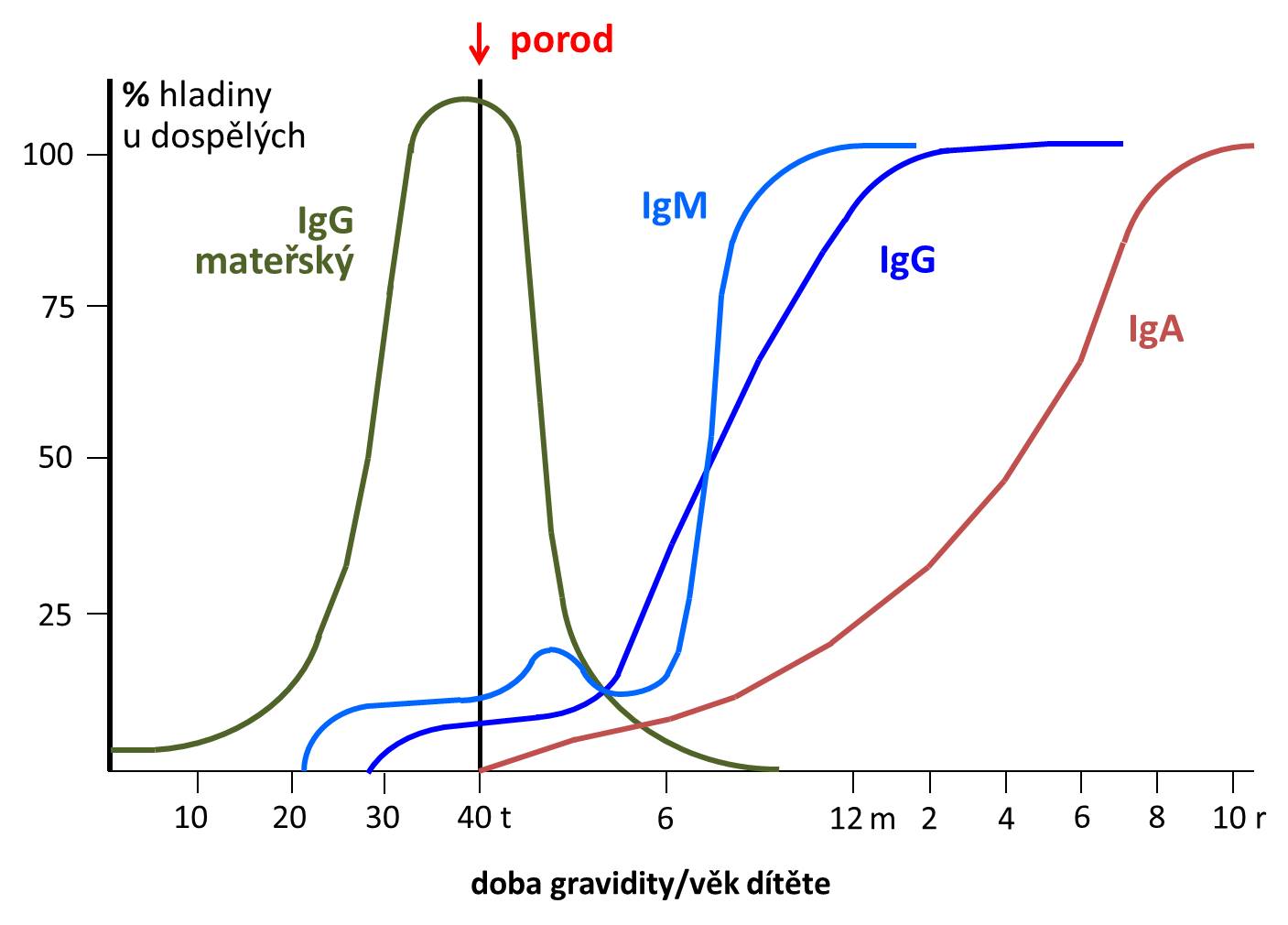
Novorozenec má malé zásoby glykogenu v játrech. To vede k rychlému poklesu glykémie a ketogenezi při hladovění. Na druhé straně rychlejší přívod glukózy např. v infúzi způsobí snáze hyperglykémii, neboť glukóza se v játrech ve formě glykogenu ještě nemůže dostatečně ukládat.
Pro novorozenecké období je typická nezralost některých enzymových a transportních systémů. Tak nezralost jaterních procesů vychytávání bilirubinu z krve a jeho konjugace je jednou z příčin fyziologického ikteru novorozence. K jeho dalším příčinám patří:
- nadprodukce bilirubinu díky kratší životnosti erytrocytů novorozence;
- interference progesteronu a některých dalších steroidů procházejících placentou či obsažených v mateřském mléce s jaterním transportem bilirubinu;
- reabsorpce nekonjugovaného bilirubinu, vzniklého v tenkém střevě působením ß-glukuronidázy; střevní baktérie, které normálně dále přeměňují bilirubin na urobilinogen, totiž ve střevě novorozence ještě nejsou přítomné.
Novorozenec má nižší glomerulární filtraci než dospělý, i když provedeme korekci podle povrchu těla. U nedonošených novorozenců je snížení zvláště výrazné. Za fyziologických okolností ledviny novorozence stačí vyloučit potřebné množství vody, minerálů i katabolitů, při zvýšené zátěži však tato funkce selhává. U kojence je snížena i schopnost ledvin (tubulů) kompenzovat acidózu.
V novorozeneckém období je 1,3 – 1,4krát vyšší spotřeba kyslíku (vztaženo na kg hmotnosti) než u starších dětí. Každé závažnější onemocnění, ale i bolest a stres při vyšetřování dítěte mohou vést k vyčerpání kyslíkové rezervy a k vývoji kardiorespirační insuficience.
U dětí ve srovnání s dospělými nalézáme nižší sérovou koncentraci lipidů (cholesterol, triacylglyceroly) a dusíkatých katabolitů (urea, kreatinin, kyselina močová). Nižší hladina pohlavních hormonů a jejich metabolitů odpovídá nezralosti pohlavních orgánů, naproti tomu zvýšená hladina fosforu a aktivita alkalické a kyselé fosfatázy odrážejí růst kostí (jejich zvýšení trvá po celou dobu růstu a kolísá podle aktivity tohoto procesu). Vyšší aktivita některých enzymů (CK, AST) v prvních dnech po porodu je následkem hypoxie svalů během porodu. U novorozenců pozorujeme významně vyšší hladiny kardiálních troponinů, aniž by se jednalo o poškození myokardu. Novorozenci a malé děti mívají odlišnou farmakokinetiku řady léčiv, vedoucí k požadavku jiného dávkování než u dětí starších a dospělých osob. Dochází snáze k retenci léčiv, která jsou vylučována glomerulární filtrací, i těch, která jsou metabolizována v játrech.
Příklady referenčních hodnot některých metod v závislosti na věku ukazuje Tabulka 2.
Tabulka 2. Orientační referenční rozmezí některých testů, jevících závislost na věku
Analyt | Novorozenci | Kojenci | Mladší děti | Dospělí |
|---|---|---|---|---|
Albumin (g/L) | 30 – 42 | 24 – 46 | 25 – 53 | 23 – 50 |
Alkalická fosfatáza (µkat/L) | 1,8 – 9,6 | 2,2 – 12,2 | 1,8 – 9,2 | 0,7 – 2,2 |
Bilirubin celkový (µmol/L) | < 200 | < 26 | < 25 | < 25 |
Vápník (mmol/L) | 1,6 – 3,0 | 2,1 – 2,8 | 2,1 – 2,6 | 2,1 – 2,6 |
GGT (µkat/L) | < 5,7 | < 3,5 | < 1,0 | muži 0,3 – 1,77 ženy 0,2 – 1,10 |
Fosfát anorganický (mmol/L) | 1,3 – 3,0 | 1,6 – 3,5 | 1,0 – 1,9 | 0,7 – 1,6 |
Draslík (mmol/L) | 4,0 – 6,6 | 3,6 – 5,8 | 3,6 – 4,8 | 3,6 – 4,8 |
Kreatinin (µmol/L) | 40 – 80 | 30 – 60 | 30 – 80 | muži 62 – 106 ženy 44 – 80 |
Kyselina močová (µmol/L) | 130 – 400 | 120 – 370 | 120 – 360 | muži 210 – 450 ženy 140 – 360 |
IgG (g/L) | 7,0 – 16,0 | 3 – 6 m: 1,8 – 8,0 6 – 12 m: 3,0 – 10,0 | 5,0 – 13,0 | 7,0 – 16,0 |
V následujících odstavcích probereme choroby, které se vyskytují jen v dětském věku a při jejichž diagnostice a sledování průběhu má laboratorní vyšetření významnou úlohu. Zmíníme se i o dědičných poruchách metabolismu – provázejí sice postiženého po celý život, ale jejich co nejčasnější diagnostika může být rozhodující pro další osud pacienta.
DĚDIČNÉ PORUCHY METABOLISMU
Dědičná onemocnění mohou být způsobena:
- změnou počtu chromosomů (Downův syndrom, Turnerův syndrom aj.) – zde se uplatňuje biochemická diagnostika poměrně málo. O vyhledávání plodů podezřelých z Downova syndromu již v prenatálním období je zmínka v kurzu o laboratorním vyšetření v gynekologii;
- strukturní změnou genu – tyto choroby se obvykle řídí při přenosu na další generaci Mendelovými zákony. Nejčastěji je poruchou genu postižena syntéza enzymu; pak se dá prokázat např. hromadění substrátu chybějícího enzymu.
Prenatální diagnostika dědičných poruch zahrnuje screening v 1. a 2. trimestru těhotenství s možností genetického vyšetření plodové vody (od 15. týdne gravidity) či bioptického vzorku choriových klků (od 9. týdne gravidity) v případě zjištěného vysokého rizika (viz kurz laboratorní vyšetření v gynekologii).
V České republice se v současnosti u všech novorozenců provádí screening 18 nejčastějších závažných dědičných poruch. K fenylketonurii a vrozené hypothyreóze byly postupně přidávány další dědičné poruchy metabolismu: kongenitální adrenální hyperplazie, cystická fibróza, řada dalších poruch metabolismu aminokyselin a mastných kyselin a konečně deficit biotinidázy. Krev novorozence se nanese na tzv. novorozeneckou screeningovou kartičku, nechá se zaschnout (metoda „suché kapky“) a odešle do jednoho z určených specializovaných center. Pravděpodobnost, že vyšetřovaný novorozenec bude trpět některým z dvaceti vyhledávaných onemocnění, je velmi malá, přibližně 1 : 1 150. Novorozenecký screening umožní včasnou léčbu nejčastějších ovlivnitelných dědičných chorob a představuje navíc i ekonomický přínos: náklady na léčbu komplikací vzniklých z pozdě diagnostikované choroby bývají mnohem vyšší.
Samozřejmě existuje množství dědičných chorob, které se nevyhledávají (jsou vzácné, neexistuje vhodná screeningová metoda nebo nejsou léčitelné). Na dědičnou poruchu je nutné myslet vždy při přítomnosti následujících příznaků:
- neprospívání dítěte;
- porucha funkce jater, patologická hodnota jaterních enzymů;
- nevysvětlitelná hypoglykémie (nalačno či po jídle);
- atypický zápach moči (aminy při některých poruchách metabolismu aminokyselin);
- nevysvětlitelná porucha acidobazické rovnováhy (např. laktátová acidóza bez hypoxie);
- záchvat křečí či naopak svalová atonie aj.
V těchto případech lze provést i některá screeningová vyšetření (chromatografie aminokyselin, organických kyselin, monosacharidů, steroidů, stanovení hladiny amoniaku aj.), ne však všechna najednou, ale výběrově podle klinického podezření. Některé dědičné metabolické poruchy se projeví závažnými život ohrožujícími stavy již u novorozenců (galaktosémie, defekty enzymů močovinového cyklu, poruchy syntézy steroidů aj.) a diagnóza musí být stanovena co nejrychleji. Jiné se projevují méně akutně, po měsících, a stav se zhoršuje zvolna (např. většina tzv. tezaurismóz).
Definitivní diagnóza, zejména u vzácnějších chorob a u heterozygotů, vyžaduje vyšetření na specializovaném pracovišti se zkušenostmi s diagnostikou dědičných metabolických chorob, vybaveném příslušnou přístrojovou technikou. Při stanovení diagnózy se mnohdy neobejdeme bez takových metod, jako jsou kapalinová chromatografie, hmotová spektrometrie a metody molekulární biologie.
Podrobněji bude o dědičných poruchách metabolismu pojednáno v samostatném kurzu.
HYPERBILIRUBINÉMIE
Fyziologicky se nahrazuje fetální hemoglobin adultním a k nárůstu bilirubinu dochází postupně v rámci adaptace novorozence na dýchání vzduchu. Patologický ikterus vzniká časně po narození, bilirubin dosahuje vysokých hodnot a trvá delší dobu (Tabulka 3).
Příčiny patologické hyperbilirubinémie, typické pro novorozenecké období, jsou např.:
- nekonjugované hyperbilirubinémie
- hemolytická nemoc novorozence při Rh či vzácněji AB0 inkompatibilitě,
- hemolýza při defektu glukóza-6-fosfát dehydrogenázy v erytrocytech,
- porucha jaterního vychytávání a konjugace bilirubinu (dědičné syndromy Rotorův, Criglerův-Najjarův);
- konjugované hyperbilirubinémie
- atrézie žlučových cest,
- novorozenecká hepatitida; její příčiny zahrnují infekci (cytomegalovirus) nebo metabolický defekt (např. galaktosémie).
Při podezření na hemolytickou nemoc novorozence se první vyšetření provádějí již prenatálně. Po narození je třeba opakovaně stanovovat hladinu bilirubinu.
Při nepřímé metodě měření transkutánním bilirubinometrem je nezbytné dodržovat následující zásady:
- při prvním měření současně stanovit koncentraci bilirubinu v krvi a podle ní přístroj „nakalibrovat“;
- vyznačit místo umístění sondy a to již při dalších měřeních neměnit;
- při fototerapii měřené místo zakrýt, aby nedošlo k falešně nízkým výsledkům pro rozpad bilirubinu v kůži.
Nekonjugovaný bilirubin je lipofilní a při přestupu do centrálního nervového systému může ireverzibilně poškodit bazální ganglia mezimozku („Kernikterus“). Jako kritická hranice se označuje koncentrace nekonjugovaného bilirubinu 340 µmol/L. Ohroženi jsou hlavně nedonošení novorozenci, kteří mají větší propustnost hematoencefalické bariéry, a všichni pacienti se sníženou koncentrací či vazebnou schopností albuminu. Vazbu bilirubinu na albumin snižují i některá léčiva, acidémie a volné mastné kyseliny.
Tabulka 3. Kritéria pro hodnocení patologické hyperbilirubinémie
- Ikterus vzniká již prvý den po porodu
- Denní nárůst bilirubinémie > 85 µmol/L
- S-bilirubin celkový > 256 µmol/L
- S-bilirubin konjugovaný > 25 µmol/L
- Ikterus trvá déle než:
- 1 týden (donošení)
- 2 týdny (nedonošení)
HYPOGLYKÉMIE
Sklon novorozenců k hypoglykémii následkem nedostatečných zásob glykogenu v játrech je fyziologický. Zvláště ohroženi jsou nedonošení novorozenci; hypoglykémie může být i příčinou křečí, při delším trvání hrozí poškození mozku. Hypoglykémie může dále nastat u novorozenců diabetických matek s hyperglykémií, u kterých jsou intrauterinně intenzivně stimulovány β-buňky pankreatu ke zvýšené produkci inzulinu.
Hypoglykémii najdeme i u některých dědičných poruch metabolismu. Hypoglykémie nalačno doprovází glykogenózu I. typu, naproti tomu u galaktosémie a hereditární intolerance fruktózy se hypoglykémie objeví po zátěži příslušným cukrem.
REYEŮV SYNDROM
Jedná se o akutní, život ohrožující onemocnění, projevující se zvracením, těžkou encefalopatií s poruchou vědomí a známkami poškození jater (je vysoká aktivita AST, ALT, roste koncentrace amoniaku, je sklon k hypoglykémii a prodloužený protrombinový čas). Etiologie Reyeova syndromu je neznámá. Obvykle navazuje na virové onemocnění, uvažuje se i o vlivu podávání kyseliny acetylsalicylové v některých případech onemocnění.
Typickou známkou stáří je polymorbidita. Z tohoto důvodu mohou být výsledky laboratorních testů ovlivněny současně několika chorobami. Protože staří lidé často užívají množství různých léků, je třeba počítat s větší možností ovlivnění výsledků podávanými léky.
Rovněž referenční hodnoty některých vyšetření mohou být u starých lidí jiné. Většinou se zde jedná o plynulé změny – mezi osobami středního věku a starými nenajdeme ostrou hranici. Z tohoto důvodu by bylo nejvhodnější mít k dispozici referenční rozmezí v závislosti na věku, např. pro jednotlivé dekády od středního věku až po věk pokročilý. Někdy se však těžko dají odlišit fyziologické změny způsobené vlastním procesem stárnutí od změn, které doprovázejí choroby a stavy vyskytující se často právě ve stáří (ateroskleróza, osteoporóza, malnutrice aj.). V některých případech je problémem u starších lidí i nežádoucí účinek léků, které často užívají (mj. diuretika, antihypertenziva aj.).
Protože ve starším věku roste prevalence mnohých závažných chorob, bylo by vhodné alespoň některé z nich cíleně vyhledávat pomocí screeningových programů, jejichž součástí je i laboratorní vyšetření.
S věkem dochází k involuci orgánů s postupným zhoršováním jejich funkce. Glomerulární filtrace plynule klesá od středního věku vlivem progresivní ztráty nefronů. Protože však současně dochází k redukci svalové hmoty a zmenšuje se příjem masa v potravě, hladina kreatininu v séru stoupá jen málo. U starších pacientů je důležité respektovat fyziologický pokles funkcí a zbytečně nediagnostikovat ledvinné onemocnění, které je nutné sledovat a léčit. Snížení glomerulární filtrace má za následek zhoršenou renální eliminaci některých léčiv a je proto větší nebezpečí předávkování (gentamicin, digoxin aj.). Ve stáří je menší i koncentrační schopnost ledvin; pro vyloučení stejného množství katabolitů tedy ledvina potřebuje větší množství tekutiny.
Koncentrace cholesterolu stoupá rovnoměrně s věkem u mužů, u žen až po menopauze. Tak je hladina cholesterolu u 65letých mužů o 10 – 30 % vyšší než u 20 – 30letých, u žen po menopauze klesá koncentrace HDL cholesterolu.
Vzestup aktivity alkalické fosfatázy, který popisují někteří autoři u osob nad 65 let věku, má nejspíše vztah k častějšímu výskytu osteoporózy a zejména Pagetovy choroby. Nárůst koncentrace prostatického specifického antigenu (PSA) s věkem je způsoben rostoucím objemem prostaty; k odlišení benigní hyperplazie od karcinomu prostaty slouží různé indexy, např. poměr volného a celkového PSA, celkového PSA a velikosti prostaty aj.
S věkem dochází postupně ke zhoršování glukózové tolerance. Abnormální odpověď na zátěž glukózou pozorujeme u 25 % osob starších 75 let, což však nutně neznamená, že by se z nich měli stát diabetici.
Ve stáří je tendence k poklesu koncentrace celkových bílkovin a albuminu v plazmě, větší pokles je však spíše ukazatelem malnutrice či zvýšeného katabolismu při chronických zánětlivých onemocněních.
Ve stáří klesá podíl vody v organismu, zejména na úkor její intracelulární složky. Stoupá práh žízně, což se projeví tendencí k vyšší osmolalitě séra.
Po zavedení hypersenzitivní metody stanovení kardiálního troponinu I či T se zjistilo, že jejich koncentrace ve stáří roste. Otázkou je, zda je to jev fyziologický nebo následek subklinického postižení myokardu: s vyšší hladinou kardiálního troponinu je totiž spojena horší prognóza nemocných vzhledem k přežití.
Ve stáří klesají funkční rezervy mnohých orgánů (ledviny, plíce, oběhový systém) a modifikují se regulační a adaptační mechanismy. Porucha funkce orgánů se proto projeví již při menší zátěži, ke které může patřit i podávání léků, dehydratace, infekce apod. Někdy se užívá termín „geriatrická křehkost“, multikauzálně podmíněný pokles adapatability s kritickým poklesem funkčních rezerv ve stáří.
Uveďme několik příkladů, kdy se chorobný stav projeví při zvýšené zátěži (zánět, hypoxie, hypovolémie při dehydrataci, porucha acidobazické rovnováhy apod.). Tak pacient s metabolickou acidózou a současným emfyzémem není schopen poruchu účinně kompenzovat hyperventilací. Zúžené cévy postižené aterosklerózou se projeví při hypovolémii (dehydrataci) nebo hypoxii, např. při otravě oxidem uhelnatým: zatímco mladý jedinec otravu překoná bez následků, u staršího člověka, kde je i za normálních okolností perfúze orgánů „na hraně“, dojde při stejném stupni otravy k ischemické příhodě mozkové či srdeční.
Vždy je třeba mít na mysli, že náhle vzniklé psychické změny, zejména zmatenost, mohou být vyvolány fyzickou poruchou, která je léčitelná (hyponatrémie, dehydratace, intoxikace oxidem uhelnatým, uroinfekce, hypoglykémie apod.).
Řada laboratorních odchylek může být nejen projevem onemocnění, ale i nesprávně vedené či nedostatečně kontrolované léčby. K častějším laboratorním odchylkám pozorovaným u starých osob patří především:
- hyponatrémie; příčinou mohou být např. thiazidová diuretika (hypovolemická forma) či městnavá srdeční slabost (hypervolemická forma);
- hypernatrémie při snížení pocitu žízně, u depresivních nebo amentních pacientů;
- hypokalémie při předávkování diuretiky (furosemid, thiazidy), která je často doprovázena hypomagnezémií;
- hyperkalémie následkem podávání kalium retenčních diuretik či inhibitorů ACE; často potencováno i poklesem funkce ledvin;
- hypokalcémie při hypovitaminóze D, malnutrici či hypoalbuminémii (pokles frakce vázané na albumin);
- hyperkalciurie u dlouhodobě imobilizovaných nemocných, kdy se vápník uvolňuje z kostí;
- zvýšení koncentrace močoviny v séru následkem dehydratace;
- hypoproteinémie jako následek poruchy nutrice; stav je vystupňován při současně přítomném zánětu;
- nález M-proteinu v rámci tzv. monoklonální gamapatie neurčeného významu, MGUS;
- větší je frekvence autoimunitních onemocnění (např. thyreopatie, revmatoidní artritida aj.);
- častější je i deficit vitamínů (hypovitaminóza C, D) či některých stopových prvků;
- anémie z nedostatku železa (hypochromní, mikrocytární) při poruchách vstřebávání železa či chronickém krvácení (i okultním – nejzávažnější příčinou je kolorektální karcinom) nebo tzv. anémie chronických chorob při zánětech a maligních nádorech (porucha distribuce železa).
Jsou choroby, které se častěji vyskytují ve starším věku a jejichž závažnost opravňuje k jejich vyhledávání screeningovými metodami v široké populaci.
K těmto metodám patří např. stanovení okultního krvácení resp. hemoglobinu ve stolici při vyhledávání kolorektálního karcinomu; v případě kvantifikace PSA u mužů k odlišení karcinomu prostaty od její benigní hyperplazie není většinou screening pomocí PSA doporučován.
Tabulka 4 shrnuje některé testy, které pomohou odhalit častěji se vyskytující chorobné stavy u starých osob. Bylo by vhodné, aby se prováděly např. v rámci přijetí starého pacienta do nemocnice, ať už z jakéhokoliv důvodu.
Tabulka 4. Příjmový screening u seniorů
Laboratorní ukazatel | Zjištěná porucha či choroba |
|---|---|
Albumin, celková bílkovina | malnutrice |
Glykémie 2 h po jídle | diabetes mellitus |
Vápník | osteomalacie (nedostatek vitamínu D) |
Draslík | hypo- či hyperkalémie (nežádoucí účinek diuretik, ACE inhibitorů, |
TSH, FT4 | hyper- či hypothyreóza |
CRP event. sedimentace erytrocytů | nespecifický ukazatel přítomnosti organické nemoci (zánět, nádor) |
- Informační portál o novorozeneckém screeningu. Dostupné z: https://www.novorozeneckyscreening.cz
- Dort, J., Tobrmanová, H.: Hyperbilirubinemie novorozence. Doporučený postup v neonatologii. Dostupné z: http://www.neonatologie.cz
- Dennis D, Bennett MJ, Wong EC (eds). Biochemical and molecular basis of pediatric disease. 4th ed., AACC Press, Washington DC, 2010
- Soldin SJ, Wong EC, Brugnara C, Soldin OP (eds). Pediatric reference intervals. 7th ed., AACC Press, Washington DC, 2011
- Howlett SE, Rockwood MRF, Mitnitski A, Rockwood K. Standard laboratory tests to identify older adults at increased risk of death. BMC Med, 12, 2014: 17