Trendy v laboratorní medicíně
| Stránky: | POSTUDIUM |
| Kurz: | Trendy v laboratorní medicíně |
| Kniha: | Trendy v laboratorní medicíně |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | pátek, 19. dubna 2024, 00.36 |
Popis
Základní učební text.
Absolvování vám zabere cca 120 minut.
Obsah
- 1. Úvod
- 2. Odběr krve a transport materiálu do laboratoře
- 3. Automatizace a robotizace provozu
- 4. Centralizace provozu vs. POCT
- 5. Konsolidace laboratorních oborů
- 6. Laboratorní medicína založená na důkazech
- 7. Personalizovaná medicína
- 8. Podíl laboratoře na screeningových programech
- 9. Standardizace metod a laboratorních postupů
- 10. Certifikace a akreditace laboratoří
- 11. Trendy v analytice
- 12. Nové biomarkery
- 13. Harmonizace laboratorní medicíny v mezinárodním měřítku
- 14. „-omiky“
- 15. Laboratorní medicína v budoucnosti
- 16. Doporučená literatura
1. Úvod
Laboratorní medicína patří mezi nejrychleji se rozvíjející obory medicíny. Cílem této kapitoly je postihnout hlavní trendy v klinické biochemii (a v celé laboratorní medicíně). Řada z nich představuje dvě strany jedné mince, které se navzájem nevylučují, ale naopak doplňují – popíšeme si výhody jednotlivých trendů a rizika jejich nevhodné aplikace. V závěru pak zkusíme odhadnout, kam bude obor v budoucnu směřovat.
2. Odběr krve a transport materiálu do laboratoře
Bezpečnostní odběr krve
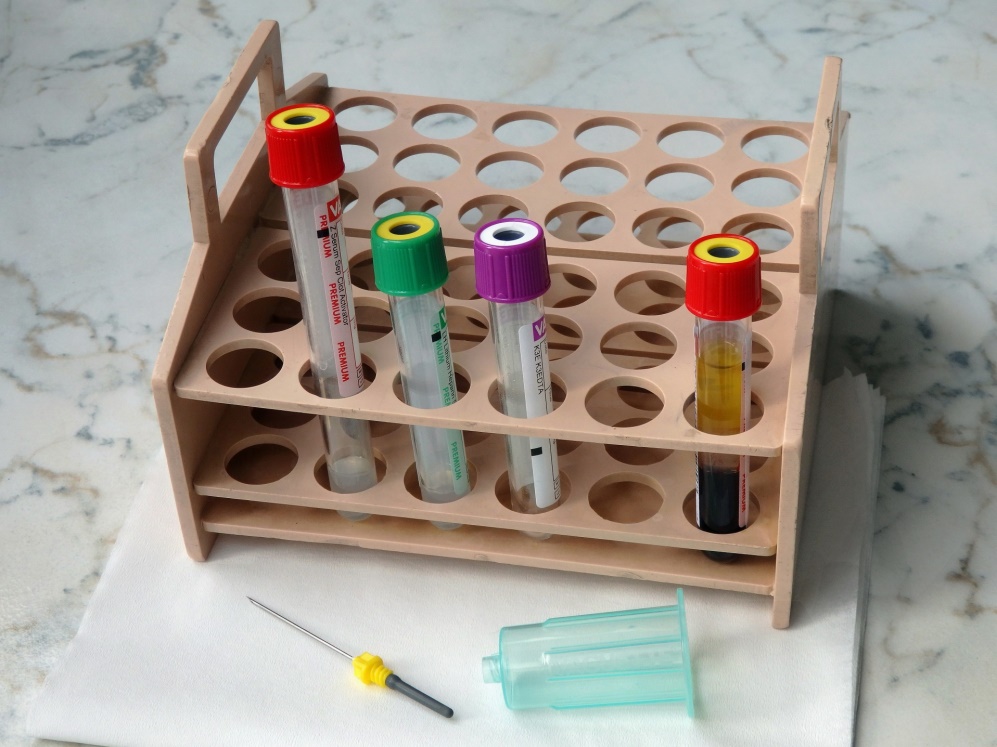
Dnes se prakticky již nesetkáme s klasickým odběrem krve pomocí jehly zapíchnuté do žíly nemocného s krví odkapávající do nádobky nebo s odběrem pomocí klasické stříkačky s pístem. Přešlo se prakticky výlučně na tzv. bezpečnostní odběr krve, ve velké většině pomocí vakuového systému; vzhledem k jeho provedení se hovoří o uzavřeném odběrovém systému. Odběrová jehla, nasazená na držák připomínající tělo injekční stříkačky, má ostrou jehlu na obou koncích – jeden se vpíchne do žíly nemocného a druhý pak propichuje gumovou membránu ve víčku vakuované odběrové nádobky. Vakuum je nastaveno tak, aby se nasál požadovaný objem krve. K dispozici je celá řada velikostí odběrových nádobek, navíc s různými přídavky (iniciátor koagulace, antikoagulační prostředky, inhibitor glykolýzy). Odběr krve je jednoduchý, je zajištěn vhodný poměr mezi množstvím krve a protisrážlivého prostředku a navíc je zdravotnický personál chráněn před potřísněním potenciálně infekční krví. Jehla propichující víčko je totiž po vytažení odběrové nádobky ihned překryta gumovým krytem.
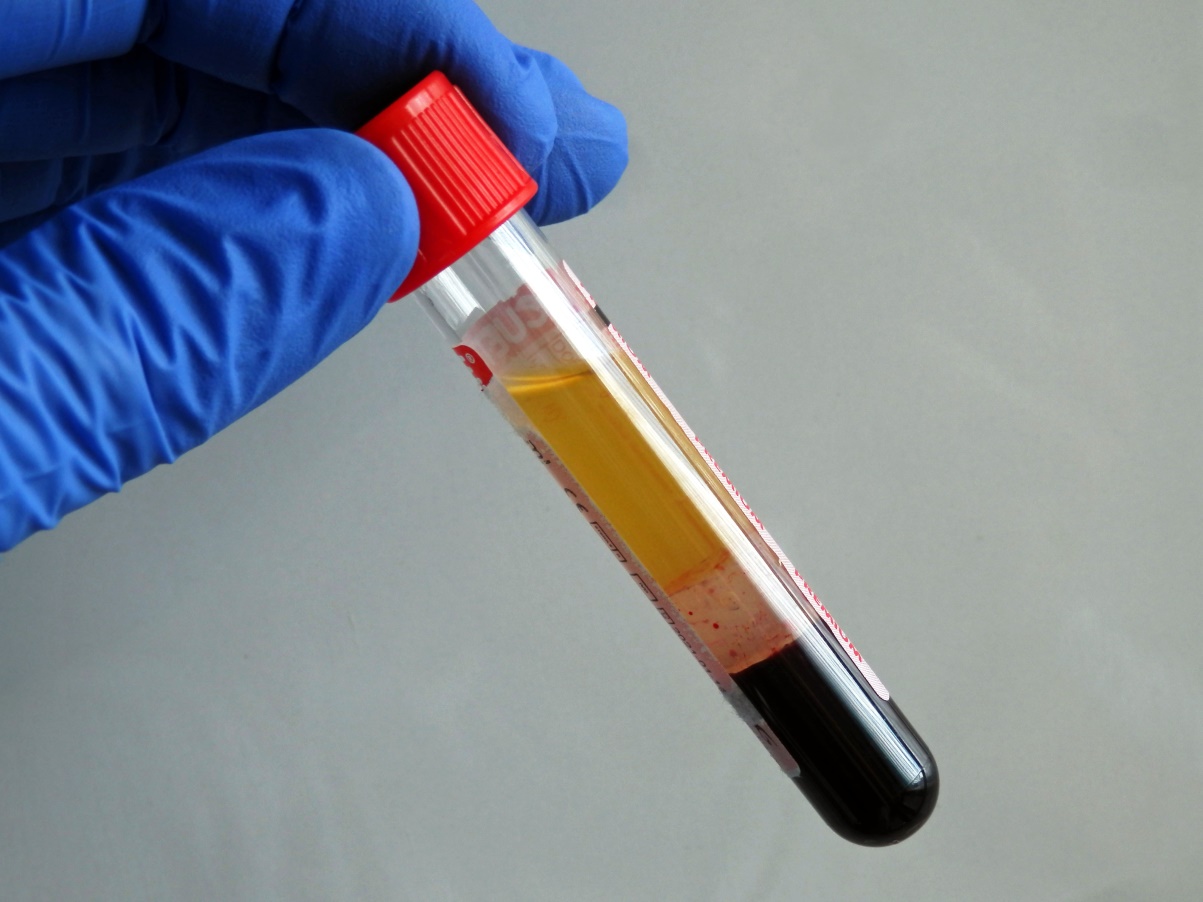
Nádobky obsahující inertní separační gel umožní dokonalé využití krevního séra či plazmy a jejich uchovávání bez potřeby přelévání do jiné zkumavky: po odstředění gel vytvoří vrstvu mezi krvinkami a tekutou částí krve a dokonale je oddělí (viz následující obrázky).
Odběrové nádobky a jehla pro odběr krve vakuovým systémem (vpravo krev po odstředění, mezi krvinkami a krevním sérem je vrstva separačního gelu).
Sérum oddělené od krvinek separačním gelem
Transport potrubní poštou
Transport biologického materiálu zprvu zajišťovali sanitáři či dokonce zdravotní sestry. Nevýhodou byla dlouhá doba transportu a zároveň chybění odborného zdravotního personálu u lůžka či na ambulanci – zdravotní sestra se má starat o nemocné a ne ztrácet čas nošením vzorku do laboratoře. Revoluční změnou je využití pneumatického transportního systému, někdy zvaného potrubní pošta. Klinická pracoviště nemocnic jsou spojena s laboratořemi (ale i s lékárnou a jinými pracovišti komplementu) systémem potrubí, ve kterém se pohybují kapsle s biologickým materiálem, poháněné stlačeným vzduchem; přetlak vytváří kompresory ve strojovně tohoto zařízení. Rychlost transportu řídí počítač a může být až 6 m/s, navíc je transport vzorku pod dokonalou kontrolou. Ve výjimečných případech může dojít vlivem akcelerace/decelarace k poškození buněk (např. nádorových bílých krvinek u leukémie).
Následující obrázky ukazují některé komponenty potrubní pošty.
Strojovna potrubní pošty s kompresory.

Transportní kapsle s biologickým materiálem (odběrová nádobky s krví a vak s krví pro transfuzi)

Elektronizace požadavků na laboratorní vyšetření
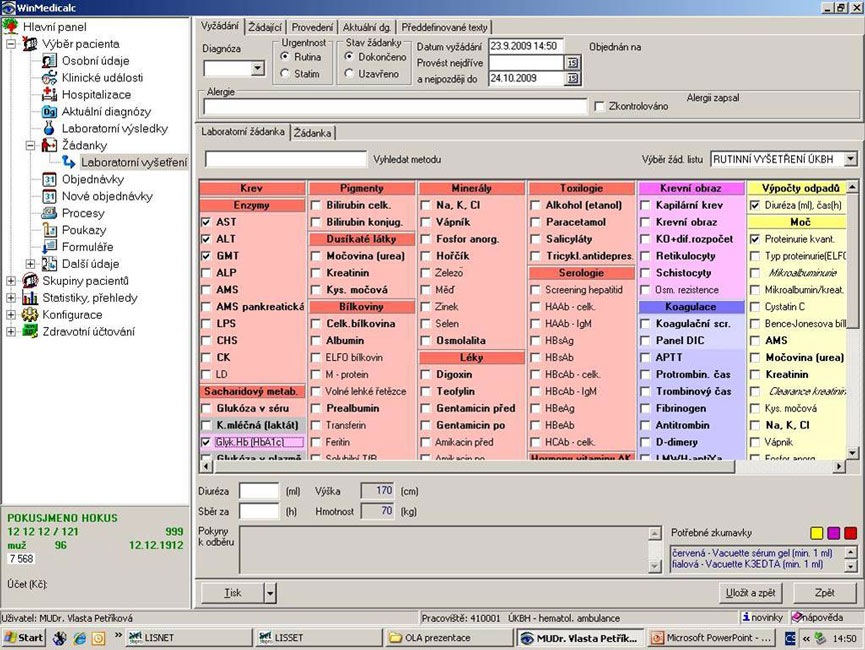
Požadavky na laboratorní vyšetření se většinou zadávají přímo na monitoru a do laboratoře se dostávají online prostřednictvím klinického a laboratorního informačního systému, bez nutnosti provázení vzorku papírovou žádankou. Příklad „elektronické“ žádanky je na následujícím obrázku.
Užití odběrových nádobek s unikátními čárovými kódy
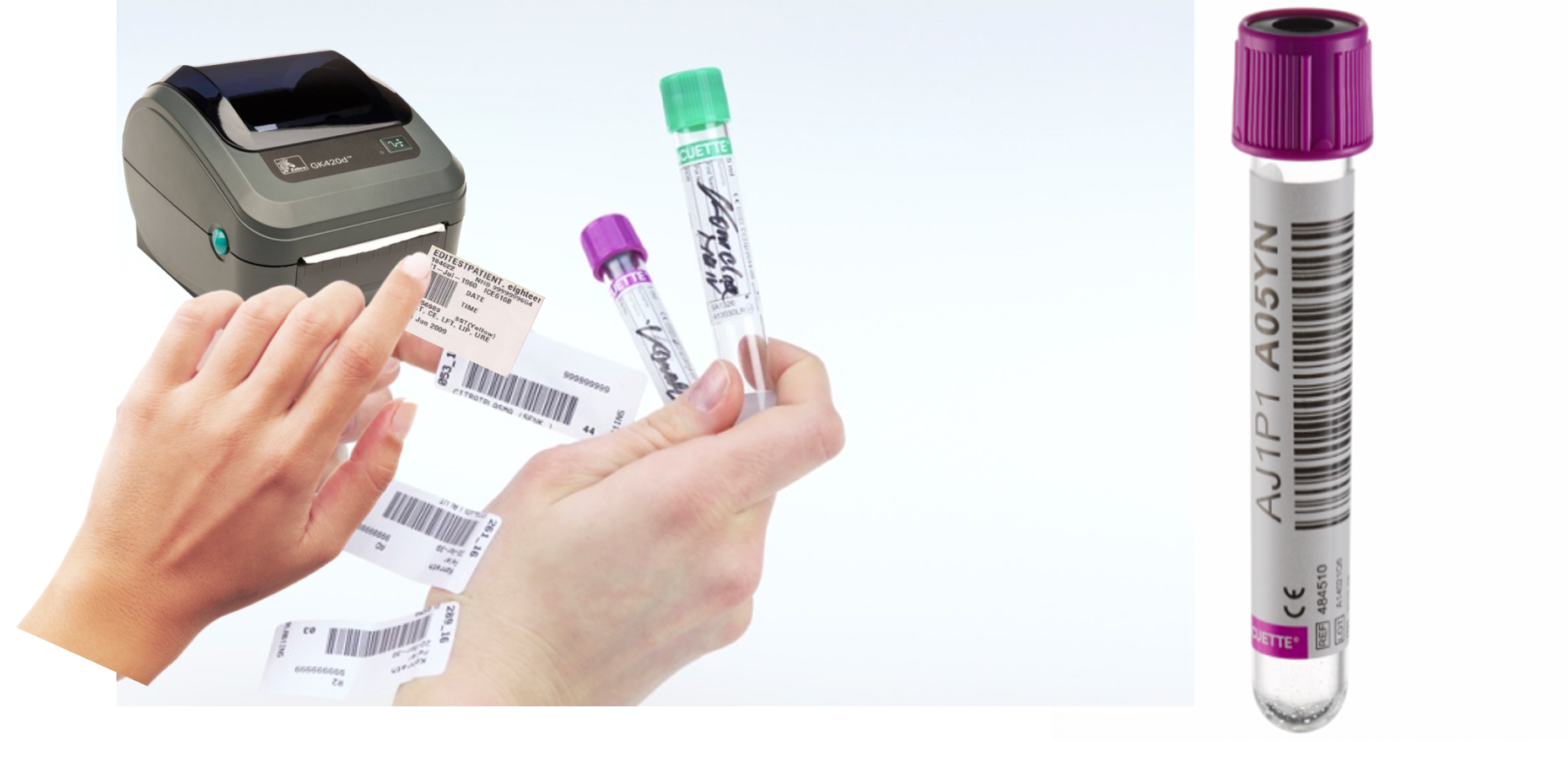
Většina laboratoří dosud pracuje se štítky, identifikujícímu pacienta, které se lepí na odběrovou nádobku. Trendem je tento krok vyloučit: odběrová nádobka je primárně označena čárovým kódem, který je kombinací a čísel unikátní (Obrázek 6). Při odběru biologického materiálu se spáruje čárový kód pacienta (např. naskenováním jeho náramku s čárovým kódem) s čárovým kódem příslušné zkumavky. Po transportu do laboratoře se jen naskenuje čárový kód na odběrové nádobce a zkumavka s biologickým materiálem se může předat k analýze; laboratorní informační systém již zná údaje o pacientovi i požadované analýzy.
Značnou výhodou tohoto systému je (kromě urychlení práce) eliminace chyb daných nesprávným značením a záměnou vzorků.
Starý způsob značení odběrových nádobek s lepením štítků (vlevo) a nádobka s unikátním čárovým kódem (vpravo).
3. Automatizace a robotizace provozu
Automatizace se nejprve týkala vlastního analytického procesu. Vyšetření bylo prováděno automatickým analyzátorem, kde všechny kroky (dávkování, inkubace, měření) jsou řízeny a kontrolovány počítačem. Automatizace vede k úsporám osob v rutinní laboratoři; ty pak mohou provádět specializované analýzy. Analyzátor umožňuje dávkování minimálních objemů s velkou přesností – šetří se tak biologický materiál i drahá činidla. Zavedení enzymových metod stanovení substrátů umožnilo jejich automatizaci (odpadla nutnost varu, předchozí deproteinace s centrifugací, práce s kyselinami a hydroxidy), zlepšila se bezpečnost práce. Automatické analyzátory různé velikosti jsou dnes prakticky ve všech laboratořích klinické biochemie; najdeme je i u metod, které se dříve považovaly za neautomatizovatelné (elektroforéza, heterogenní imunoanalýza, vyšetření močového sedimentu s analýzou obrazu aj.). Přiklad automatizované linky je na následujícím obrázku.
Automatizace analytického procesu byla postupně doplňována automatizací preanalytické a postanalytické fáze – vznikly tak plně automatizované linky a zcela se změnila práce laborantů. Preanalytická část umožňuje automatické odstředění, odvíčkování odběrové nádobky, alikvotaci (odpipetování potřebného množství pro speciální analýzy); primární zkumavka pak pokračuje pomocí transportní linky do vlastního analyzátoru. Po změření analyzátor vydá výsledek a vzorek pokračuje k archivaci v chladicím boxu, kde je k dispozici pro event. další nebo opakovaná vyšetření.
Analyzátory jsou vybaveny detektorem sraženiny, hladiny vzorku i ochranou před nárazem jehly na překážku. Jsou schopny automaticky ředit vzorek a opakovat analýzu při vysoké koncentraci analytu či doplnit z diagnostického hlediska vhodné vyšetření (tzv. reflex testing).
Cílem automatizace musí být zbavit pracovníky v laboratoři zbytečné práce a uvolnit je pro práci specializovanou. Nesmí vést k růstu nákladů ani k prodloužení doby odezvy laboratoře. Netýká se jen analytické a preanalytické fáze, musí pomáhat i s interpretací výsledků (CDS – clinical decision system).
4. Centralizace provozu vs. POCT
Vznik velkých centralizovaných laboratoří byl umožněn automatizací provozu. Můžeme se tak setkat s ohromnými automatizovanými laboratořemi, které vznikají v nemocnicích, mnohde však dokonce bez návaznosti na nemocnice či jiná zdravotnická zařízení – materiál získávají svozem z velkého regionu. V tomto případě je nezbytné vytvořit detašované „statimové“ laboratoře ve zdravotnickém zařízení. Centralizace je ekonomicky výhodná, na druhé straně někdy představuje továrnu na výsledky sice s přesnou analýzou, poněkud se však ztrácí vlastní pacient. Při svozu biologického materiálu na velkou vzdálenost je třeba zajistit udržení jeho kvality – už jsme uvedli, v preanalytické fázi může dojít k závažným chybám, které se projeví nesprávným výsledkem.
Opakem centralizace je provádění vyšetření v blízkosti nemocného – na operačním či porodním sále, na jednotce intenzivní péče, v ambulanci urgentního příjmu či ve voze záchranné služby. Tento způsob se nejčastěji zkracuje POCT (point-of-care testing); jiné názvy jsou např. „bed-side diagnostics“ nebo „near-patient testing“. Pokud si pacient provádí vyšetření sám doma, hovoří se o „self-monitoringu“, někdy se užívá i termín „home testing“.
POCT má význam tam, kde není laboratoř k dispozici nebo kde potřebujeme výsledek extrémně rychle.
K výhodám POCT ve srovnání s prováděním vyšetření v centrální laboratoři patří:
- výsledek je dispozici dříve;
- kvalita vzorku není ovlivněna transportem;
- minimální riziko záměny vzorku.
Nevýhodou je naopak:
- horší preciznost, často nižší analytická citlivost a menší rozsah měření;
- obvykle vyšší cena;
- analýzu provádí zdravotnický personál (nejčastěji zdravotní sestry), který se v době analýzy nemůže věnovat pacientovi
- nutnost opakovaného školení – vyšetření provádí „nelaboratorní“ personál, někdy dokonce pacient.
Uveďme příklady situací a metod, kde je měření v režimu POCT vhodné. Doma si diabetik měří glykémii, nemocní léčení warfarinem protrombinový čas. V terénu je vhodné měření glukózy, alkoholu, drog; na jednotce intenzivní péče jednoduché přístroje měří krevní plyny a acidobazickou rovnováhu, minerály, glukózu, laktát; na dialyzačním středisku draslík; v ordinaci praktického lékaře moč chemicky, glukózu, CRP.
Někdy se vyšetření provádí, aniž je třeba přístrojová technika a výsledek se odečítá okem: chemické vyšetření moči pomocí diagnostického proužku, kvalitativní průkaz drog v moči apod. Jindy se k vyšetření používá přístroj – od jednoduchého glukometru až po přístroj umožňující vyšetření vnitřního prostředí či celé sady analytů (kardiomarkery, renální testy, dokonce krevní obraz či sérologie některých infekčních chorob). Aby bylo možné provádět měření v režimu POCT, musí být k dispozici přístroj s co nejjednodušší obsluhou, kterou zvládne laik (a dokonce i pacient) po zaškolení a vyšetření se musí provádět z plné krve (či moči, v případě alkoholu z vydechovaného vzduchu, u drog i ze slin). POCT přístroje v nemocnici vyžadují možnost identifikace pacienta a přenosu výsledku do laboratorního informačního systému. Jejich zapojení do systému kontroly kvality je základním předpokladem, stejně tak jako supervize ze strany laboratoře.
Centralizace se vyplatí u metod méně častých a drahých – zkrátí dobu odezvy a zlevní vyšetření. V režimu POCT provádíme vyšetření, kde potřebuje lékař (či pacient) velmi rychle výsledek a může na něj rychle adekvátně reagovat. Nejistota výsledku (viz strana 15) stanovená POCT vyšetřením, je obvykle vyšší a před zavedením je nutné pečlivě zvážit, zda analytické vlastnosti metody vyhovují klinickému použití. Příkladem nevhodného využití je vyšetření mikroalbuminurie v ordinaci diabetologa – výsledek ukazuje hrozbu rozvoje cévních komplikací, které se rozvíjejí roky, není tedy třeba bezprostředně po odběru moči. Jiným příkladem je kvalitativní imunochemický průkaz hemoglobinu ve stolici, který řekne méně než test kvantitativní.
V budoucnu se dá očekávat velký rozvoj přístrojů a tedy i metod, nabízející provedení formou POCT. Věřme, že jejich využití bude sledovat zájmy nemocného a budou vhodně doplňovat vyšetření prováděná v klinických laboratořích.
Příklady přístrojů určených k analýzám v režimu POCT jsou na následujícím obrázku (POCT (vlevo kazeta pro imunochemický průkaz drog, uprostřed osobní glukometr, vpravo analyzátor krevních plynů, minerálů a substrátů).
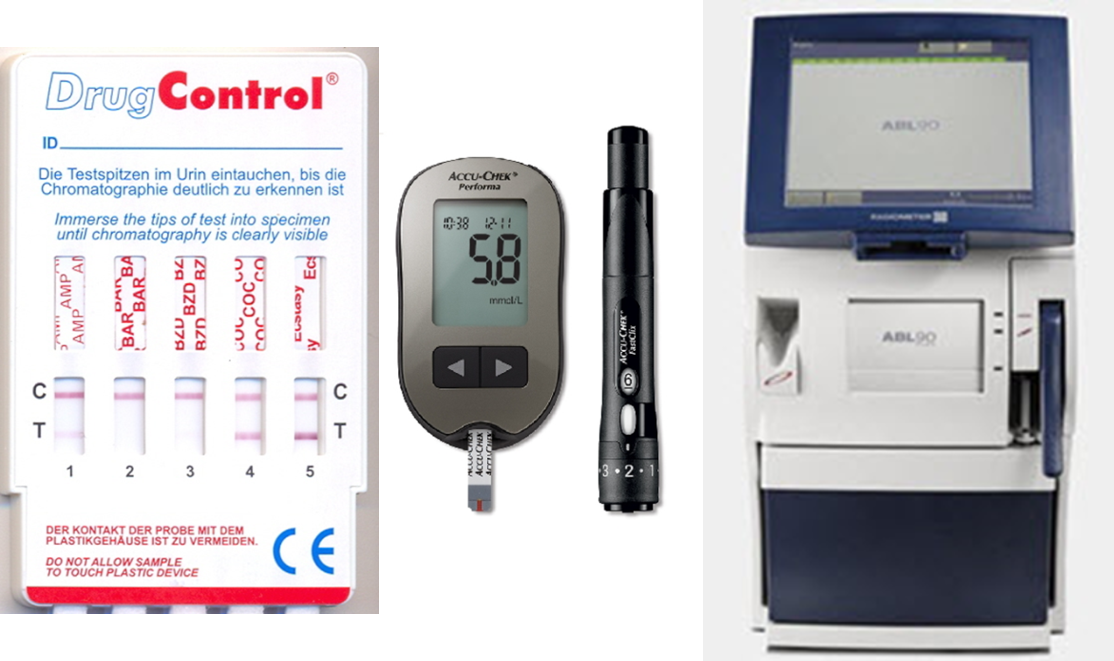
5. Konsolidace laboratorních oborů
V České republice byly tradičně laboratorní obory rozdrobeny podle jednotlivých odborností. Konsolidace znamená sdružování laboratoří různých odborností. Vzniká tak jedno pracoviště laboratorní medicíny, provádějící vyšetření biochemická, hematologická, imunologická, molekulárně biologická, sérologická, chromatografická (hmotnostní spektrometrie) apod. I když je většina provozu společná a využívána různými odbornostmi, interpretace výsledků je samozřejmě v rukou příslušných odborníků-garantů. Výhodou je společný příjem biologického materiálu, úspora biologického materiálu a tím šetření pacienta, společné využívání přístrojů i personálu či snazší interpretace výsledků. O ekonomickém přínosu není třeba diskutovat – přesvědčivým důkazem je, že v soukromých laboratořích se tento trend bez problémů prosazuje. Ve státních laboratořích konsolidaci brání tradiční roztříštěnost laboratoří v České republice a mnohdy i vedoucí jednotlivých laboratoří.
6. Laboratorní medicína založená na důkazech
V posledních desetiletích jsme svědky extrémního nárůstu počtu laboratorních testů, zobrazovacích metod, léků, a to navíc od různých výrobců. Nutně pak vznikají otázky: Mám zavést navrhovanou metodu a opustit starou? Je tento lék účinnější než jiný? Mám vybrat tuto firmu nebo jinou? Je to levnější, ale i stejně kvalitní?
Reakcí na záplavu nových metod i léků je tzv. medicína založená na důkazech (evidence-based medicine, EBM). Její využití si ukážeme na dvou příkladech.
Tak při zavádění nové metody je třeba srovnat ji s metodou dosavadní (např. stanovení kardiálních troponinů oproti myoglobinu či CK-MB); srovnáváme preciznost, rušivé vlivy jiných složek krevního séra (interferenci), počet falešně negativních a falešně pozitivních výsledků, stabilitu reagencií, analytickou citlivost a měřicí rozsah, cenu jednoho stanovení a mnoho dalších parametrů. Jen tak zodpovědně posoudíme, zda je navrhovaná metoda přínosem. Může se totiž například stát, že zdánlivě levná metoda je méně citlivá, má menší stabilitu činidel či měřicí rozsah apod., a její zavedení tedy není vhodné.
EBM se uplatňuje i při zavádění nových léků: jeho součástí může být celá řada laboratorních testů, které ukazují nejen účinnost léku, např. v případě testování hypolipidemik, ale i možné nežádoucí účinky – např. hepatotoxický či nefrotoxický účinek. Zásadně se užívají multicentrické studie s účastí řady center z mnoha zemí, celkem tisíce až desetitisíce účastníků studie. Studie jsou prospektivní, kontrolované placebem, dvojitě zaslepené se sofistikovaným statistickým zhodnocením. Samozřejmě i zde se sleduje ekonomická stránka, možné nežádoucí účinky léku apod.
Jen podle výsledků výše uvedených sledování a studií se rozhodne o dalším vývoji léku, reagencie apod. Vždy je třeba brát v úvahu i to, že každá firma má zájem svůj výrobek prosadit. Navíc metaanalýza dříve publikovaných výsledků studií může trpět i tím, že negativní výsledky jsou méně ochotně přijímány k publikaci, což může vést k přecenění výsledků pozitivních. Rozhodující je jednoznačně prokázaný přínos pro pacienta.
7. Personalizovaná medicína
Jsou případy, kdy se užije lék vyhodnocený jako účinný metodou EBM, přesto se však najdou jedinci, na které lék nezabere. Nebo naopak: ve velké studii lék propadne, ale u malého počtu jedinců zabere. Selhává zde medicína založená na důkazech? Ne, jen se projevují rozdíly mezi jednotlivými osobami, dané geneticky. Neexistuje totiž „průměrný“ člověk, každý z nás je individuum s jinou genetickou výbavou. Někomu chybí příslušný receptor (lék nezabere, nemá se na co vázat) nebo ho naopak má (lék proto zabere). Někdo metabolizuje lék pomalu (při běžném dávkování se projeví toxické nežádoucí účinky), jiný rychle (lék se rychle odbourá a neúčinkuje). Uveďme opět několik příkladů, kdy znalost genetické výbavy jedince umožňuje správě rozhodnout o léčbě. Hovoří se o personalizované medicíně, léčbě „ušité pacientovi na míru“.
Produkt genu Her-2/neu u nemocných s karcinomem prsu působí jako růstový faktor. Jeho zablokování lékem Herceptinem vede ke zpomalení růstu nádoru; lék je však účinný jen u osob, kde je v nádorové tkáni prokázán uvedený gen.
Množství léků je přeměňováno v játrech na neaktivní produkt komplexem enzymů zvaným cytochrom P450. Znalost jeho typu, který určuje aktivitu enzymu, umožní adekvátní dávkování léků. Obrázek 2 ilustruje, jak mutace v genu pro cytochrom P450 vede k jeho nižší aktivitě, což má po podání stejné dávky léku za následek řádově vyšší koncentraci než u normálního enzymu (viz následující obrázek).
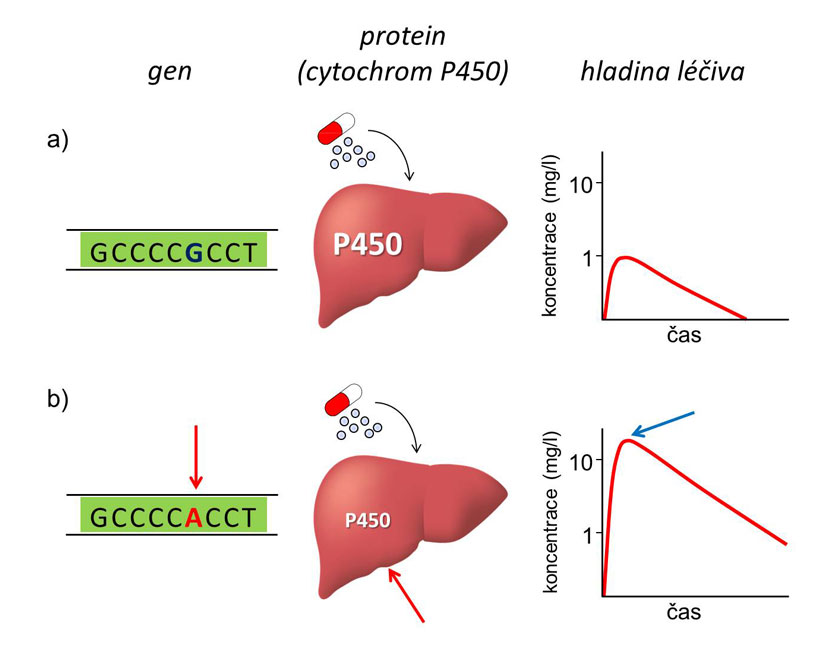
Věda zabývající se dědičně podmíněnou variabilitou odpovědi organismu na léky se nazývá farmakogenetika.
8. Podíl laboratoře na screeningových programech
Screeningová vyšetření významně pomáhají najít chorobu v časné, mnohdy bezpříznakové fázi a umožnit její účinnou léčbu, jinde odhalí rizikový faktor onemocnění, který se dá životosprávou či léčbou ovlivnit. Součástí mnohých screeningových programů jsou laboratorní vyšetření. Klinická biochemie a laboratorní medicína vůbec se v poslední době stále více soustřeďuje na prevenci; screeningová vyšetření v tom hrají významnou roli.
Příkladem může sloužit:
- screening vrozených vývojových vad v těhotenství;
- novorozenecký screening;
- screening diabetu a rizikových faktorů u dospělých (glykémie, lipidy);
- screening kolorektální karcinomu (hemoglobin ve stolici);
- screening karcinomu děložního hrdla (cytologické vyšetření stěru děložního čípku).
Problémem v současnosti není nedostatek screeningových metod, ale spíše nezájem ze strany obyvatelstva; odhaduje se, že účast na screeningových metodách se v průměru pohybuje jen kolem 40 %. I proto přistoupila Všeobecná zdravotní pojišťovna k adresnému zvaní osob, kterých se screening týká.
9. Standardizace metod a laboratorních postupů
Cílem je, aby výsledky všech laboratoří byly srovnatelné. Je to nezbytné pro bezpečnost pacientů, pro jejich řádné vyšetřování a léčbu, např. při překladu z jednoho zdravotnického zařízení do jiného. Srovnatelnost výsledků je zajištěna užíváním firemních souprav reagencií, které prošly validací u výrobce a verifikací u uživatele, návazností kalibrace, i systémem kontroly kvality. Ve všech laboratořích je zavedena interní kontrola kvality (IKK, IQC) a je povinná účast v systémech externího hodnocení kvality (EHK, EQA); příklad certifikátů, potvrzujících účast v systému EHK, ukazuje následující obrázek. Význam má i respektování doporučení odborných společností. Ověření výše uvedených skutečností je zajištěno systémem auditů, jak bude zmíněno v další kapitole.

10. Certifikace a akreditace laboratoří
Laboratoře pracují podle zásad správné laboratorní práce (SLP, GLP – good laboratory practice); mezi tyto zásady patří i výše zmíněná kontrola kvality. Kvalita metod se navíc prokazuje jejich validací výrobcem a verifikací deklarovaných vlastností metody v laboratoři samotné. Kontroluje se např. preciznost a další vlastnosti.
Laboratoře prokazují, že systém řízení kvality v laboratoři je v souladu s předepsanou normou – tento proces se nazývá certifikace. Nejznámější normou je norma ISO 9001 stanovující požadavky na systém řízení kvality. Je součástí rodiny mezinárodních standardů vydávaných Mezinárodní organizací pro standardizaci ISO (International Organization for Standardization).
Akreditace je pak úřední uznání laboratoře vykonávat činnost. Akreditace zdravotnických laboratoří je prováděna podle normy ČSN EN ISO 15189 Zdravotnické laboratoře – Zvláštní požadavky na kvalitu a způsobilost. Tato obsáhlá mezinárodní norma uvádí požadavky na způsobilost a jakost zdravotnických laboratoří. Služby zdravotnické laboratoře jsou základem péče o pacienta, laboratoř proto musí být připravena splnit požadavky všech pacientů i klinického personálu odpovědného za péči o pacienty. Tyto služby zahrnují organizaci příjmu, identifikaci a přípravu pacienta, odběr, dopravu, skladování, zpracování a vyšetřování klinických vzorků, následné ověření, interpretaci, předkládání zpráv a poradenskou činnost a navíc hodnocení bezpečnosti a etiky práce zdravotnické laboratoře.
V České republice provádí akreditační proces Český institut pro akreditaci (ČIA), přípravu k procesu zajišťuje Národní autorizační středisko pro klinické laboratoře (NASKL), a to formou auditů. Povinná akreditace ČIA je v ČR u genetických laboratoří, u ostatních laboratoří je sice nepovinná, liší se však platba zdravotními pojišťovnami za výkony; z tohoto důvodu mají prakticky všechny laboratoře klinické biochemie akreditaci podle ISO 15189 (ČIA) nebo audit II NASKL.
Popsaný proces je nepochybně potřebný a vnesl řád do práce laboratoří. Musí laboratořím pomáhat zvyšovat kvalitu, nikoliv jim přidělávat práci; nesmí se zapomínat, že laboratoře tu jsou pro nemocné a musí garantovat, že výsledky budou věrohodné (zásada „patient safety“).
11. Trendy v analytice
V posledních desetiletích zažívají bouřlivý rozvoj molekulárně biologické metody. Někdy se hovoří také o DNA diagnostice. Molekulární biologie je vlastně biochemie nukleových kyselin a bílkovin.
Tento rozvoj byl umožněn znalostí struktury a funkce DNA, ale i rozvojem nových analytických metod a patřičnou přístrojovou technikou; zmiňme některé z objevů:
- metoda polymerázové řetězové reakce (PCR), následně pak sekvenační metody včetně sekvenování nové generace;
- znalost lidského genomu, nekódující DNA (ncRNA), mikroRNA (miRNA), dlouhé nekódující RNA (lncRNA), jejich regulační funkce apod.
Molekulárně biologické metody umožnily detekci dědičných metabolických chorob na úrovni DNA. Dnes je známo více než 10 000 dědičných chorob, způsobených mutací jednoho genu (monogenic diseases); v r. 2008 to bylo jen něco přes 400! Další oblastí jejich využití je detekce odchylek u malignit (např. leukémie, ale i u solidních nádorů); jejich znalost umožní kromě klasifikace nádoru i určení účinné léčby. Identifikace infekčních agens na podkladě detekce specifického úseku DNA (RNA) a identifikace jedince pro soudnělékařské účely představují další pole využití molekulárněbiologických metod.
Zmíníme ještě jeden typ přístrojové techniky, který se stále častěji uplatňuje a stává se pomalu nutným vybavením klinické laboratoře. Je to chromatograf (plynový, kapalinový) spojený s detektorem založeným na hmotnostní spektrometrii (GC-MS, LC-MS), či dokonce s dvěma hmotovými spektrometry – kapalinová chromatografie spojená s tandemovou hmotnostní spektrometrií (LC-MS/MS). Tyto přístroje se uplatňují zejména v proteomice, ale i při stanovení hladin léků a v toxikologii.
12. Nové biomarkery
Pojem biomarker (marker) je v posledních letech stále častěji užíván. Existuje několik definicí tohoto pojmu, my se budeme držet následující: biomarker je znak, který je objektivně měřitelný a hodnotitelný jakožto ukazatel normálních či patologických biologických procesů nebo odpovědi na léčbu. Biomarkery jsou často laboratorní testy – známe kardiální, kostní, tumorové markery, markery sepse atd. Užívají se v diagnostice, prognostické markery předpovídají osud nemocného, prediktivní markery se snaží předpovědět, zda bude nemocný odpovídat na danou terapii, další markery se užívají pro sledování odpovědi organismu na léčbu. Objevují se stále nové, specifičtější a citlivější biomarkery, které umožňují včasnou diagnostiku i výběr vhodné léčebné metody. Jednotlivé markery včetně těch nejnovějších jsou probrány v příslušných kapitolách, týkajících se laboratorního vyšetřování u onemocnění příslušných orgánů a orgánových systémů.
13. Harmonizace laboratorní medicíny v mezinárodním měřítku
Mezinárodní i Evropská federace klinické chemie a laboratorní medicíny (IFCC, EFLM) jsou velmi aktivní na poli standardizace a harmonizace nejen vlastních analytických postupů, ale i preanalytické a postanalytické fáze laboratorního vyšetření a samozřejmě interpretace výsledků. Příkladem může sloužit řada komisí a pracovních skupin, které se zabývají jednotlivými oblastmi laboratorní medicíny včetně jednotek (podrobněji viz https://www.ifcc.org/ a https://www.eflm.eu).
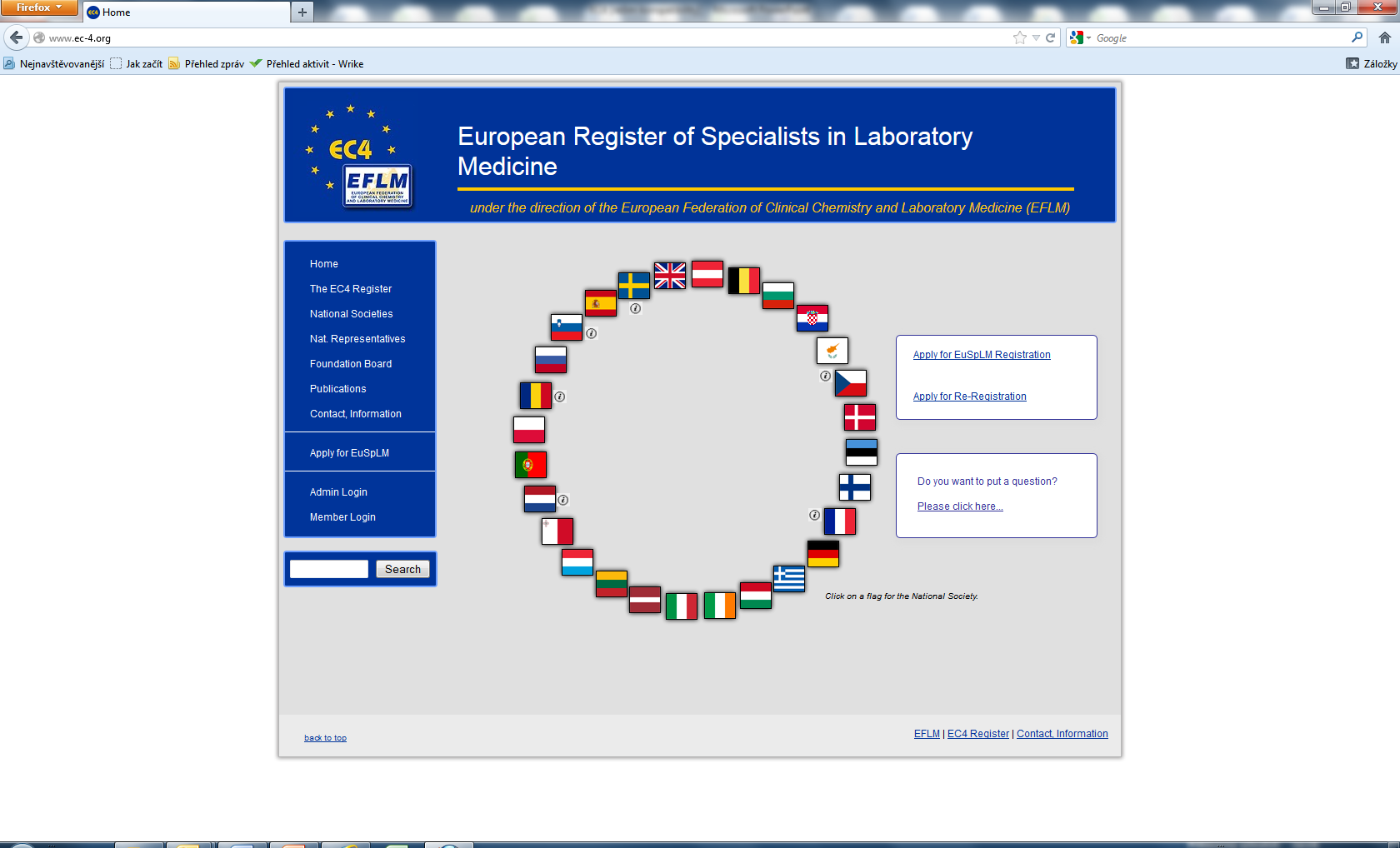
EFLM si dala za cíl zajistit ekvivalentní a vysokou úroveň vzdělávání odborníků v klinické chemii a laboratorní medicíně v rámci celé Evropské unie a uznání povolání specialisty v laboratorní medicíně ve všech zemích EU. Konečným cílem je umožnit tak zaměstnání příslušných odborníků kdekoliv v EU.
K dosažení tohoto cíle je třeba harmonizovat vzdělávací proces v rámci celé EU. Doba trvání vzdělávání musí být nejméně 9 let, z čehož pregraduální vzdělávání (academic education) v trvání nejméně 5 let a postgraduální příprava (specialist training) nejméně 4 roky, zakončená příslušnou zkouškou. Postgraduální vzdělávání musí obsahovat v rovnováze čtyři základní disciplíny (klinická chemie/imunologie, hematologie/krevní transfúze, mikrobiologie, genetika) a jeho obsah musí odpovídat tzv. Evropskému sylabu. V České republice splňuje tyto požadavky ze všech laboratorních oborů pouze klinická biochemie.
Webové stránky pracovní skupiny Register, zajišťující uznávání kvalifikace Evropského specialisty v laboratorní medicíně (EuSpLM).
14. „-omiky“
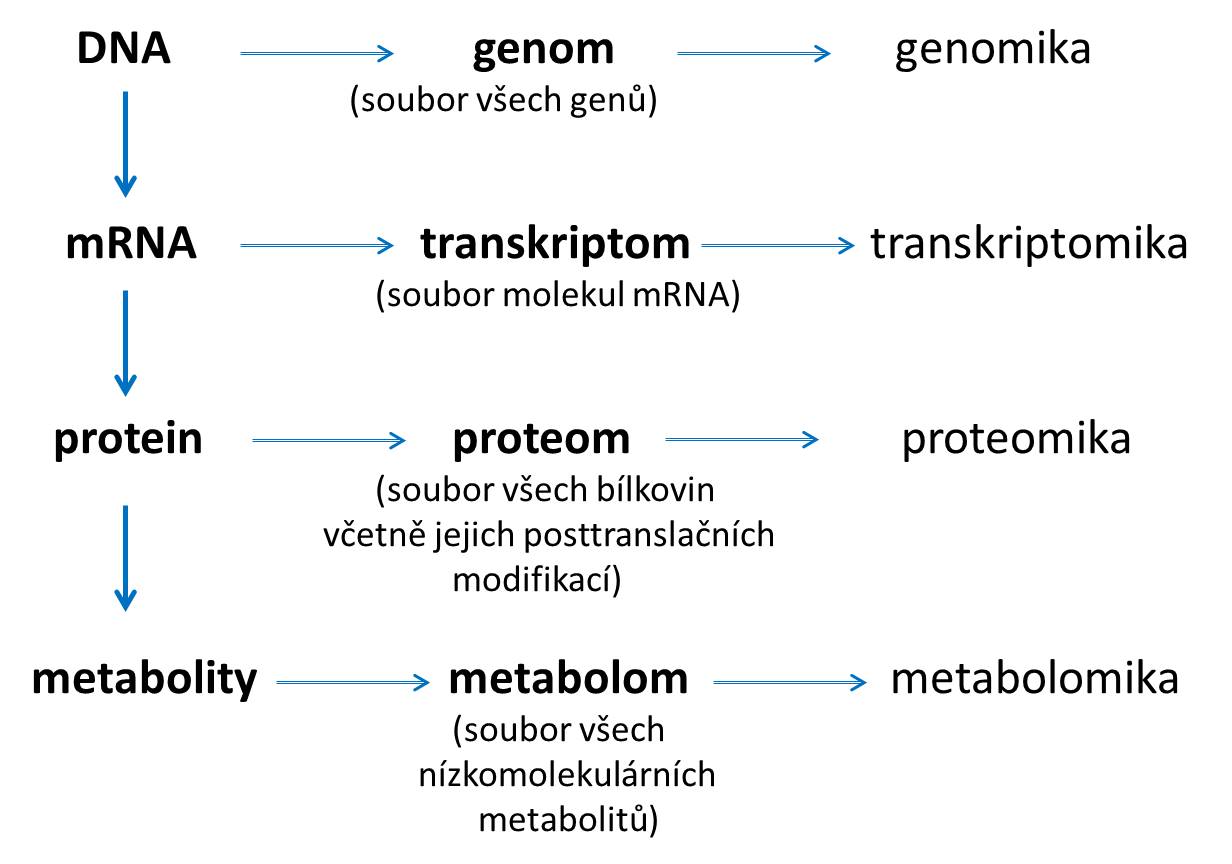
Soubor všech genů jednotlivého organismu se nazývá genom; tento pojem je obecně známý a každý ví, že je již známý genom řady organismů včetně lidského. Jen některé geny jsou však aktivní, dochází k jejich expresi, tj. podle nich se vytváří mediátorová RNA (transkripce) a podle ní se pak v ribosomech syntetizují bílkoviny (translace). Soubor všech mediátorových RNA se nazývá transkriptom. Při regulaci projevů genetické informace se podílí celá řada vlivů zevního prostředí (např. pH, oxidační stres), metylace DNA či acetylace proteinů na ní navázaných – histonů, ale i celá řada dalších molekul včetně tzv. mikroRNA. Interakcí prostředí a genomu se zabývá epigenetika. Pojmem proteom označujeme soubor všech bílkovin, typických pro určitou buňku, tkáň či tekutinu, ve zdraví i za nemoci. Zahrnuje i všechny posttranslační modifikace molekul bílkovin (např. glykosylace, fosforylace apod.), které mohou být typické pro určitou tkáň či chorobný proces. Konečně pod pojmem metabolom si představujeme soubor všech metabolitů v tělních tekutinách, které se zase mohou lišit při různých chorobných stavech. Věda, které zkoumá změny v genomu, se nazývá genomika, obdobně známe transkriptomiku, protemiku a metabolomiku. Uvedené pojmy schematicky znázorňuje následující obrázek. Většina z těchto metodických přístupů zůstává na poli výzkumu, dá se však očekávat, že v brzké budoucnosti budou jejich poznatky využity i v klinické praxi.
Měli bychom se zmínit i o souboru všech genů mikrobiální flóry přítomné v našem organismu – nazývá se mikrobiom. Bylo zjištěno, že zejména mikroby v trávicím traktu nejsou pouhými symbionty, ale že svým složením a metabolismem významně ovlivňují zdravotní stav člověka.
15. Laboratorní medicína v budoucnosti
Jak bude vypadat rozvoj laboratorní medicíny v nejbližší budoucnosti? Dá se očekávat další postup automatizace a robotizace laboratorního procesu. Zcela nepochybně budou k dispozici další metody, prováděné v režimu POCT; doufejme v jejich rozumné využití. Pochopení regulací buněčného metabolismu (aterogeneze, onkogeneze) umožní vznik nových léků, ale i preventivních opatření. Laboratoře se budou stále více podílet na monitorování léčby včetně tzv. biologické léčby. Personalizovaná medicína umožní léčbu podle genetického podkladu zejména u onkologických pacientů. Při hodnocení ohromného množství údajů, které mají různý charakter a exponenciálně rostou (tzv. „big data“), budou pomáhat speciální programy. V každém případě je třeba si uvědomit, že v záplavě údajů, sofistikovaných přístrojů a různých předpisů se nesmí ztrácet pacient: vše musí směřovat k lepší péči o nemocného, včasné diagnostice chorobných stavů a k jejich prevenci.
16. Doporučená literatura
- Greves PR, Haystead TAJ. Molecular biologist´s guide to proteomics. Microbiol Mol Biol Rev, 66(1), 2002: 39-62
- Larsson A, Greig-Pylypczuk R, Huisman A. The state of point-of-care testing: a european perspective. Ups J Med Sci, 120(1), 2015: 1-10
- McQueen MJ. Overview of evidence-based medicine: Challenges for evidence-based laboratory medicine. Clin Chem, 47(8), 2001: 1536-46
- Schneiderka P (ed.). Správné zavádění a používání prostředků POCT. Doporučení České společnosti klinické biochemie, 2011
- Slanař O. Farmakogenomika – současnost, budoucnost, perspektiva. Klin Farmakol Farm, 26(3), 2012: 126-30
- Strimbu K, Tavel JA. What are biomarkers? Curr Opin HIV AIDS, 5(6), 2010: 463-6
- The EC4 European Syllabus for Post-Graduate Training in Clinical Chemistry and Laboratory Medicine: version 4 – 2012. Clin Chem Lab Med, 50(8), 2012: 1317-28
- The European Register of Specialists in Clinical Chemistry and Laboratory Medicine: Guide to the Register, Version 3-2010. Clin Chem Lab Med, 48(7), 2010: 999-1008
- The Register of Specialists in Laboratory Medicine (EuSpLM). Dostupné z: https://www.eflm.eu/site/page/a/135