Laboratorní vyšetření u diabetu
| Stránky: | POSTUDIUM |
| Kurz: | Diabetes mellitus & laboratorní vyšetření |
| Kniha: | Laboratorní vyšetření u diabetu |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | sobota, 27. července 2024, 09.01 |
Popis
Základní učební text.
Absolvování vám zabere cca 120 minut.
Obsah
- 1. Úvod
- 2. Inzulin, jeho vznik a účinek
- 3. Klinické a laboratorní známky diabetu
- 4. Typy diabetu
- 5. Genetika diabetu
- 6. Stanovení glukózy v krvi (glykémie)
- 7. Diagnostika diabetu
- 8. Laboratorní kontrola diabetu
- 9. Stanovení inzulinu a C-peptidu
- 10. Stanovení autoprotilátek
- 11. Komplikace diabetu
- 12. Možnosti léčby diabetu
- 13. Ostatní příčiny hypo- a hyperglykémie
- 14. Doporučená literatura
1. Úvod
Diabetes mellitus je závažné metabolické onemocnění, jehož incidence jeví ve vyspělých, ale i v rozvíjejících se zemích stále rostoucí tendenci. Zatímco před 30 lety bylo v Československu asi 4 % diabetiků, dnes jejich podíl na celkové populaci České republiky přesáhl 8,5 %; je přitom pravděpodobné, že asi 5 % procent osob má diabetes, aniž by o tom věděli, dalších 5 % má tzv. prediabetes. Odhaduje se, že během následujících 20 let vzroste počet diabetiků v rozvinutých zemích o dalších 20 %, v rozvíjejících zemích až o 70 %. Při zachování současného trendu bude např. v USA v r. 2050 třetina populace trpět diabetem. Příčinou je zejména nezdravý životní styl a rostoucí podíl obézních osob. Trend ve vývoji počtu diabetiků ve světě a jeho aproximaci do r. 2030 ukazuje následující obrázek.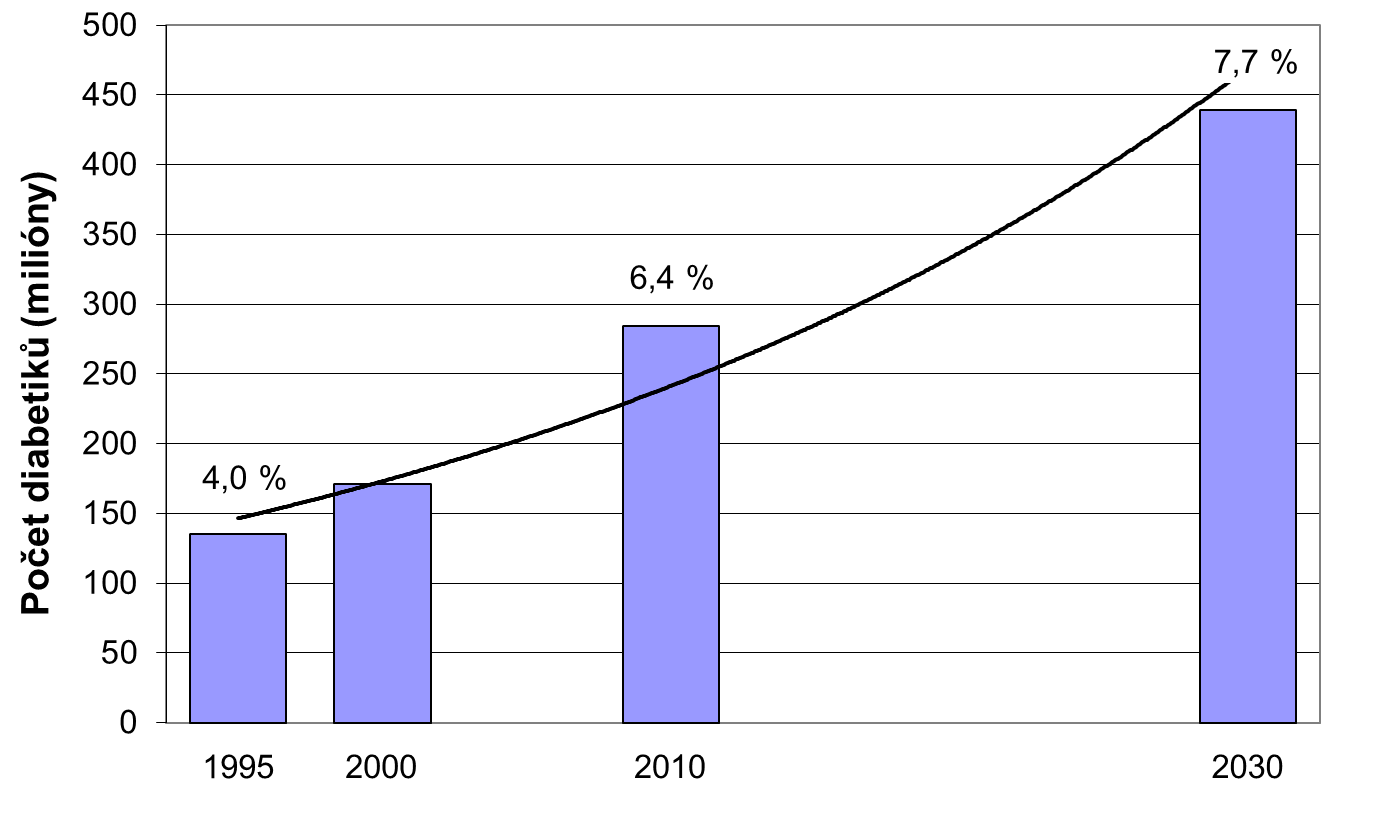
Diabetes mellitus je onemocnění velmi závažné z hlediska možných komplikací, které zkracují život nemocného a navíc nadměrně finančně zatěžují zdravotní systém. Nesmírně důležitá je včasná diagnostika onemocnění: odhaduje se totiž, že v současnosti 20 – 30 % čerstvě diagnostikovaných nemocných má již pozdní komplikace diabetu. Protože ty se rozvíjejí postupně, po sedmi i více letech trvání onemocnění, mohl být diabetes u těchto osob rozpoznán již před řadou let a následně i adekvátně léčen. Laboratorní vyšetření hraje zásadní roli:
- v diagnostice onemocnění;
- v kontrole průběhu a úspěchu léčby;
- při včasném odhalení hrozících komplikací.
2. Inzulin, jeho vznik a účinek
Inzulin je hormon, produkovaný β-buňkami Langerhansových ostrůvků pankreatu jako reakce na hyperglykémii.Vznik inzulinu
Inzulin vzniká nejprve jako preproinzulin, který se po odštěpení signálního peptidu mění na proinzulin. Tento peptid obsahuje jeden řetězec a celkem tři disulfidové můstky. Před sekrecí inzulinu je proinzulin hydrolyticky štěpen; produktem je vlastní inzulin a C-peptid, které jsou secernovány v ekvimolárním množství do krve. Molekula inzulinu je tvořena dvěma peptidovými řetězci, označovanými A (21 aminokyselin) a B (30 aminokyselin), spojenými dvěma disulfidovými můstky. C-peptid je jednoduchý peptidický řetězec o 31 aminokyselinách. Své jméno dostal od skutečnosti, že v molekule proinzulinu spojoval oba řetězce budoucího inzulinu (C = connecting, spojující). Molekula inzulinu se skladuje jako hexamer, přičemž jednotlivé molekuly inzulinu jsou spojeny atomem zinku; vlastní účinný inzulin je monomer. Vznik inzulinu je schematicky znázorňuje následující obrázek:
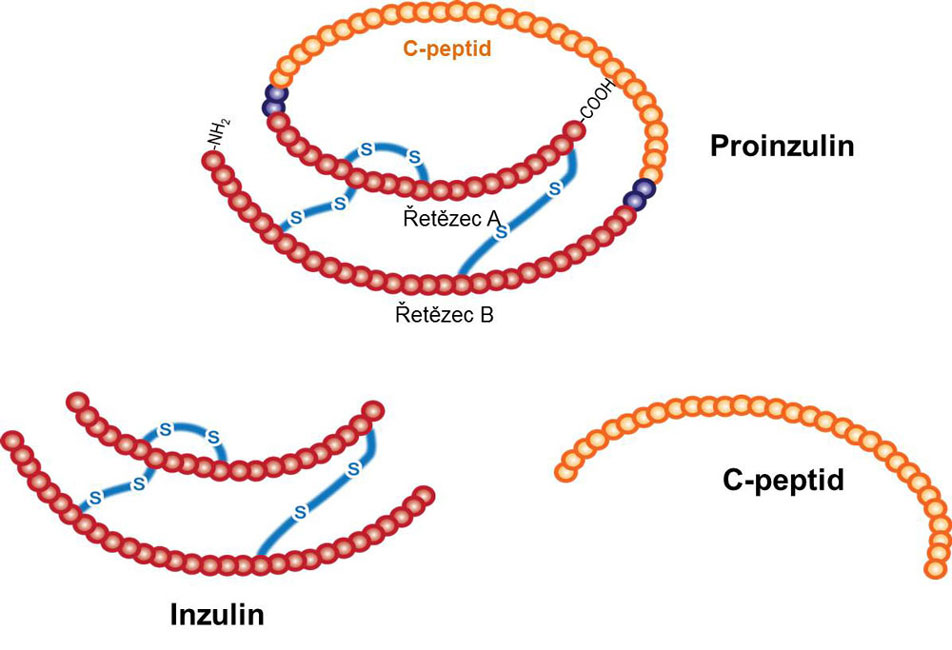
Účinek inzulinu
Tvorbu inzulinu stimuluje hyperglykémie. Asi polovinu secernovaného inzulinu představuje tzv. bazální sekrece, další část je vyplavována jako reakce na přívod potravy. Inzulin se váže na extracelulární část α-podjednotky membránového receptoru; to způsobuje konformační změny receptoru s aktivací kinázové domény intracelulární části β-podjednotky receptoru. Autofosforylace tyrozinových zbytků zahajuje kaskádu reakcí, na jejímž konci je přechod glukózového transportéru GLUT4 do buněčné membrány – tím je umožněn vstup glukózy do buňky. Nejvíce se uplatňuje účinek inzulinu v buňkách kosterního svalu (potřeba energie pro pohyb), v buňkách tukové tkáně (ukládání energie do zásoby) a v jaterních buňkách (reguluje produkci glukózy – glykogenolýza, glukogeneza) Některé buňky, jako např. erytrocyty či buňky CNS, inzulin pro vstup glukózy nepotřebují.
3. Klinické a laboratorní známky diabetu
Klinické známky diabetu vycházejí především ze ztrát glukózy močí, doprovázených osmotickou diurézou. Nemocný má tedy polyurii (zvýšený objem moči), následně polydipsii (nadměrně pije) a ubývá na váze, neboť ztrácí energeticky bohaté látky (glukózu, mnohdy i ketolátky) močí.Laboratorní známky diabetu mohou být velmi snadno odvozeny ze znalostí účinku inzulinu (resp. podle absence jeho účinku):
- hyperglykémie (glukóza nemůže pronikat do buněk pro chybění inzulinu či inzulinovou rezistenci, je zvýšená produkce glukózy v játrech);
- glykosurie (při překročení tzv. renálního prahu pro glukózu převýší nabídka glukózy buňkám proximálního tubulu ledvin jejich absorpční maximum a glukóza se dostane do definitivní moči);
- ketonémie a ketonurie (buňkám chybí glukóza, musí tedy získávat energii štěpením tuků resp. mastných kyselin; ty však nejsou schopny dokonale spálit, aniž by se současně nemetabolizovala glukóza. Výsledkem je tvorba ketolátek – kyseliny acetoctové, β-hydroxymáselné a acetonu. Uvedené kyseliny jsou příčinou metabolické (keto)acidózy.
4. Typy diabetu
Diabetes mellitus není jednotné onemocnění. Podle etiologie ho lze rozdělit na:- diabetes mellitus 1. typu (DM1), diabetes mellitus 2. typu (DM2);
- gestační diabetes mellitus (GDM);
- ostatní typy diabetu, doprovázející jiná, definované onemocnění. Stručně charakterizujme jednotlivé typy diabetu.
Diabetes mellitus 1. typu (DM1)
Onemocnění tvoří méně než 10 % všech případů diabetu. Postihuje většinou mladé jedince, často vzniká již v dětském věku; proto dřívější označení »juvenilní«. Jde o skutečný defekt tvorby inzulinu, vyvolaný postupnou destrukcí β-buněk Langerhansových ostrůvků. Příčinou je autoimunitní proces, kdy specifické cytotoxické T-lymfocyty působí destrukci β-buněk pankreatu. Současně prokazatelné autoprotilátky jsou dalším dokladem pro autoimunitní původ onemocnění, nemají však cytotoxický účinek. Postižení jedinci mají vrozenou dispozici, ke vzniku choroby jsou však nutné zevní podmínky, které spustí autoimunitní reakci. Může jít o modifikaci buněk Langerhansových ostrůvků infekčními vlivy (viry), chemikáliemi, uvažuje se i možnosti „mimikrů“, tj. podobnosti antigenů mikrobů a β-buněk, které se pak stávají cílem autoimunitního procesu. Nemocní mají sklon k rozvoji ketoacidózy. Pomalu se rozvíjející diabetes 1. typu v dospělosti bývá označován LADA (Latent Autoimmune Diabetes in Adults). Příčinou onemocnění je absolutní nedostatek inzulinu a závislost nemocného na jeho podávání.
Diabetes mellitus 2. typu (DM2)
Sem patří většina diabetiků a jejich počet neustále narůstá. Onemocnění postihuje starší osoby, velmi často obézní (s obezitou abdominálního typu). V poslední době však pozorujeme posun počátku onemocnění do mladšího věku; příčinou je zejména nadměrný přívod energie a zároveň nedostatečná fyzická aktivita u geneticky predisponovaných osob. Stav je charakterizovaný inzulinovou rezistencí, kterou se organismus zprvu snaží překonat zvýšenou produkcí inzulinu (hyperinzulinismus); v pokročilejším stadiu produkce inzulinu klesá. Glykémie nalačno zůstává zprvu normální, ale postprandiální glykémie je již zvýšená (viz následující obrázek; x = časová osa, y = výše ukazatele; podrobnější vysvětlení v textu); IS = inzulinová sekrece; IR = inzulinová rezistence; FG = glykémie nalačno; PPG = postprandiální glykémie).
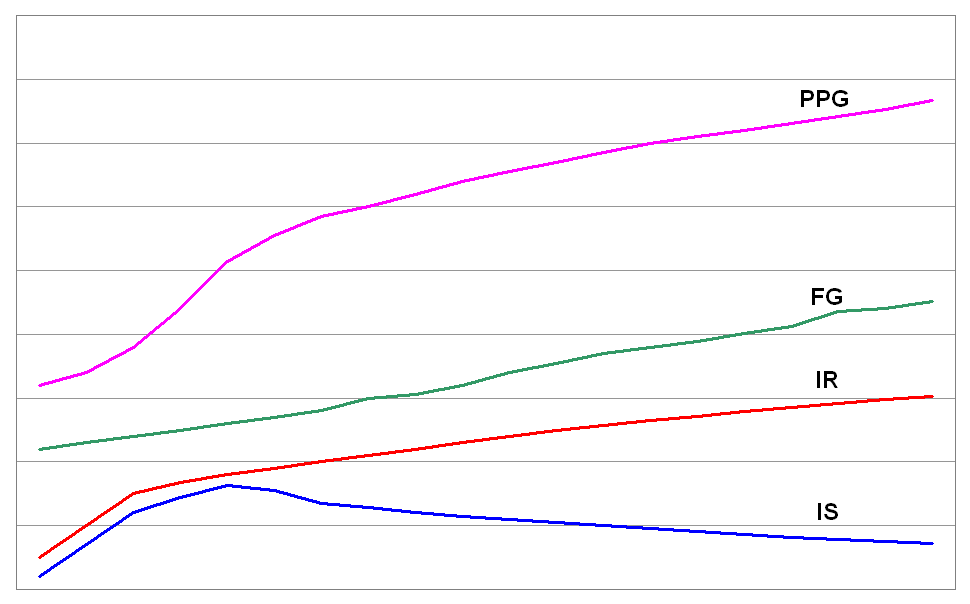
V počátečních stadiích diabetu je zachovaná sekrece inzulinu, a proto ho není třeba podávat. V pozdějších stadiích, kdy je již sekreční schopnost β-buněk Langerhansových ostrůvků vyčerpána, a při komplikacích (infekce, operace apod.) je i zde léčba inzulinem nezbytná.
Obezita, metabolický syndrom a diabetes
Obezita se v posledních desetiletích projevuje jako epidemicky se šířící onemocnění. Jak jsme uvedli v předchozích odstavcích, důvodem je vysoký energetický přívod a zejména klesající pohybová aktivita, tedy nedostatečný energetický výdej. Odhaduje se, že asi 80 % dospělé populace v USA trpí nadváhou a 60 % osob má nadváhu. V České republice se obezita stává rovněž problémem, bohužel se často vyskytuje již už u mladých osob či dokonce u dětí.
Tuk uložený centrálně, především ve viscerální oblasti se nechová pasivně, ale produkuje množství cytokinů, z nichž mnohé mají prozánětlivé účinky a vyvolávají inzulinovou rezistenci. Metabolický syndrom, jehož pravidelnou součástí je inzulinová rezistence, představuje vysoké riziko vzniku diabetu 2. typu, ale i kardiovaskulárních onemocnění včetně jejich závažných komplikací, jako je infarkt myokardu či cévní příhoda mozková, zvýšené je i riziko zhoubných nádorů jako kolorektálního karcinomu. Vztah diabetu a obezity je někdy v anglosaské literatuře vyjadřován termínem „diabesity”.
Podaří-li se nemocnému snížit tělesnou hmotnost, významně stoupne inzulinová senzitivita a upraví se i další metabolické odchylky, např. poruchy metabolismu lipidů. Klesne i riziko rozvoje kardiovaskulárních komplikací.
Gestační diabetes mellitus (GDM)
Pojmem gestační diabetes mellitus je označována porucha tolerance glukózy vzniklá v těhotenství, která odpovídá kritériím pro diabetes mellitus nebo pro porušenou glukózovou toleranci. V současnosti je u nás toto onemocnění diagnostikováno asi u 5–15 % těhotných. Všechny těhotné ženy jsou podrobeny screeningu gestačního diabetu. Zvýšené riziko rozvoje gestačního diabetu mají ženy nad 30 let, s diabetem v rodině, nadváhou a ty, které porodily plod o hmotnosti nad 4000 g.
Po porodu se může metabolismus glukózy matky upravit, tyto ženy mají však v budoucnu vyšší riziko rozvoje klasického diabetu 2. typu.
Diabetes mellitus a těhotenství
Diabetes matky představuje nebezpečí pro matku, ale i pro plod. Vyskytuje-li se v prvém trimestru (v období organogeneze) častěji těžší hypoglykémie nebo hyperglykémie, může způsobit závažné vrozené poruchy, zahrnované pod pojem diabetické embryopatie. V dalším období je plod ohrožen spíše hyperglykémií. Rozdíl glykémie mezi a. a v. umbilicalis totiž roste s hodnotou glykémie matky. Tak při glykémii 5,5 mmol/L je to 0,16 mmol/L, zatímco při glykémii 11,0 mmol/L činí rozdíl už 1,16 mmol/L. Tedy v plodu diabetiček zůstává mnohem více glukózy než u nediabetických matek. Plod má pak velkou porodní hmotnost, bývá však přitom nezralý a hrozí poranění v průběhu porodu s krvácením do mozku či asfyxie; hovoříme o diabetické fetopatii.
Fétus snižuje glykémii matek vyšší vlastní produkcí inzulinu, což po porodu může způsobit jeho hypoglykémii.
Ostatní specifické typy diabetu
Existuje řada jiných onemocnění, která mohou vést k destrukci β-buněk Langerhansových ostrůvků pankreatu či vyvolat diabetes jiným mechanismem. Patří sem např. akutní pankreatitida, chronická pankreatitida či hemochromatóza, které ničí pankreas. Hyperglykémie může být prvním projevem rakoviny pankreatu. Jinou příčinou může být nadprodukce kortikosteroidů (Cushingův syndrom) či častěji dlouhodobá terapie vysokými dávkami steroidních hormonů. Příčinou tzv. steroidního diabetu je stimulace štěpení jaterního glykogenu a zejména podpora glukoneogeneze, tedy tvorby glukózy z bílkovin (resp. glukogenních aminokyselin).
5. Genetika diabetu
Diabetes mellitus 1. typu je typické multifaktoriální onemocnění s poměrně silnou genetickou složkou. I když se v poslední době našla řada genů, asociovaných s tímto typem diabetu, nejlépe jsou prozkoumány alely hlavního histokompatibilního systému (HLA) II. třídy, které se podílejí na 30 – 50 % genetického rizika rozvoje onemocnění. Mezi dětmi s DM1 je asi 50 % jedinců s vysoce rizikovým genotypem HLA DR3/4-DQ8. Jedinci s tímto genotypem a s genotypem DR4/DR4, mající v rodinné anamnéze toto onemocnění, mají 20% riziko, že v průběhu dětství se u nich objeví autoprotilátky; u jedinců s tímto genotypem bez rodinné zátěže je riziko 5%. Další studium genů asociovaných s DM1 má značný význam zejména v souvislosti s budoucí preventivní léčbou.Diabetes mellitus 2. typu je komplexní onemocnění, v jehož etiopatogenezi se uplatňují genetické faktory i vliv prostředí. Asociační studie objevily asi 40 genů se vztahem k diabetu 2. typu. Osoby, mající jednoho z rodičů s diabetem 2. typu, mají 40% pravděpodobnost, že se u nich během života vyvine toto onemocnění, potomci obou rodičů s DM2 onemocní dokonce se 70% pravděpodobností. Konkordance mezi monozygotními dvojčaty je 70 %, mezi dizygotními jen 20 – 30 %. Je nesporné, že významný je i vliv prostředí, zejména nezdravý způsob života s nadměrným přívodem a nedostatečným výdejem energie. Podle jedné z hypotéz se DM2 objevuje jako následek genetické selekce typů uchovávajících energii v podobě zásobního tuku, což jim umožnilo přežití období nedostatku. Dnes však tento genotyp představuje zvýšené riziko obezity centrálního typu a s ní spojené inzulinové rezistence až diabetu 2. typu.
V některých případech byly objasněny mutace konkrétního genu, např. pro glukokinázu, genu pro inzulin, inzulinový receptor, genů pro nukleární transkripční faktory řídící vývoj β-buněk apod. Nemocní spadají do klinické jednotky zvané MODY (Maturity Onset Diabetes of the Youngs). Diabetes se u nich manifestuje obvykle před 25. rokem věku a zprvu nevyžaduje léčbu inzulinem; průběh a riziko komplikací závisí na typu mutace.
6. Stanovení glukózy v krvi (glykémie)
Stanovení glukózy v krvi patří k základním vyšetřením u diabetika, užívaným v diagnostice i kontrole léčby.Druh a konzervace biologického materiálu pro stanovení glykémie
V podstatě užíváme dvojí biologický materiál:
- žilní krev; přídavek antikoagulantu (K3EDTA, Na2EDTA) brání sražení krve, zatímco fluorid sodný (NaF) slouží jako inhibitor glykolýzy a zajišťuje stabilní koncentraci glukózy po dobu nejméně 24 hodin. Protože fluorid sodný inhibuje až jeden z posledních enzymů glykolýzy (enolázu), jako vhodnější se jeví okyselení krve citrátovým pufrem, kdy je glykolýza zastavena okamžitě. Plazma žilní krve je nezbytná pro diagnostiku diabetu. Někdy je stanovována koncentrace glukózy v séru žilní krve – obvykle tehdy, kdy jsou požadována další laboratorní vyšetření. Předpokladem pro tento způsob je včasné oddělení séra od erytrocytů;
- kapilární krev (obvykle z bříška prstu) slouží ke kontrole léčby diabetika. Pacient si může glykémii stanovit sám pomocí osobního glukometru, stejně tak se vyšetřuje glykémie v režimu POCT na jednotkách intenzivní péče, operačních sálech či na oddělení akutního příjmu nemocnic. Kapilární krev je možné též odeslat k vyšetření do laboratoře či shromažďovat doma při vyšetření glykemického profilu; v tomto případě se krev odebírá do konických nádobek z plastu („eppendorfek“), obsahujících antikoagulant a inhibitor glykolýzy; je třeba zajistit, aby byl odebrán patřičný objem krve, odpovídající přídavku konzervačního činidla, a po odběru obsah zkumavky promíchat. Jinou možnost představuje odběr přesného množství kapilární krve (obvykle 20 μl) do krátké kapiláry a její převedení do malé zkumavky s lyzačním roztokem; tím je zajištěna stabilita glykémie při transportu do laboratoře.
Metody stanovení glykémie
Ke stanovení glykémie slouží metody spektrofotometrické a elektrochemické. Spektrofotometrické metody jsou vhodné pro velké série vyšetření a jako materiál užívají krevní plazmu nebo sérum. Jsou dvě:
- metoda glukóza oxidázová, kdy je glukóza oxidována vzdušným kyslíkem. Reakci katalyzuje glukózaoxidáza a vzniká δ-glukonolakton a peroxid vodíku. Ten pak v další reakci, katalyzované peroxidázou, působí oxidaci bezbarvého chromogenu na barvivo;
- metoda hexokinázová, kdy je glukóza přeměněna v reakci s ATP na glukóza-6-fosfát; reakci katalyzuje hexokináza. Glukóza-6-fosfát je pak oxidován koenzymem NADP+ na kyselinu 6-fosfoglukonovou, reakci katalyzuje glukóza-6-fosfátdehydrogenáza. Vzniklá redukovaná forma koenzymu NADPH absorbuje ultrafialové světlo s maximem při vlnové délce 340 nm.
Elektrochemické metody využívají imobilizovanou glukózaoxidázu a detekují vzniklý peroxid vodíku. Při jeho oxidaci na anodě vzniká elektrický proud, jehož velikost je úměrná koncentraci glukózy. Na tomto principu pracují jak velké laboratorní glukometry, zpracovávající naředěnou kapilární krev, tak osobní glukometry, do kterých se vkládá diagnostický proužek, na který se nenese kapilární krev přímo. Výhodou elektrochemických metod je možnost pracovat s plnou krví (nevadí optické vlastnosti vzorku), potřeba krve při užití osobních glukometrů je minimální, řádově několik µl.
7. Diagnostika diabetu
Jak bylo uvedeno v předchozí kapitole, podle doporučení České diabetologické společnosti a České společnosti klinické biochemie je pro diagnostiku diabetu jediným přípustným biologickým materiálem plazma žilní krve.Pro diabetes mellitus svědčí, je-li hladina glukózy v plazmě žilní krve:
- ≥ 7,0 mmol/L, byl-li pacient nalačno;
- ≥ 11,1 mmol/L, není-li jisté, zda se jednalo o odběr nalačno.
Tato hodnota však musí být potvrzena z nového odběru krve, a to v jiný den. Je-li uvedená hodnota zjištěna jen jednou, pro stanovení diagnózy musí být navíc přítomny typické klinické známky diabetu.
Jestliže je uvedená glykémie nalezena jen jednou a nemocný nemá klinické známky diabetu nebo je-li hladina glukózy v plazmě žilní krve nalačno v rozmezí 5,6 – 6,9 mmol/l (tedy mírně zvýšená), musí být diagnóza diabetu potvrzena (nebo vyloučena) pomocí zátěžového testu – orálního glukózového tolerančního testu (oGTT).
Glukózový toleranční test (oGTT)
Indikace k provádění oGTT jsou uvedeny v předchozích odstavcích. Důležité je nemocného poučit o přípravě k testu. Alespoň tři dny před testem by měl nemocný jíst normální stravu bez omezení sacharidů, od večera je nalačno.
Vlastní test spočívá v zátěži 75 g glukózy, podané per os. Nemocný během minuty vypije roztok se 75 gramy glukózy, ochucený obvykle citrónem nebo kyselinou citronovou. Pak zůstává v klidu a po dvou hodinách následuje další odběr žilní krve. Podle hodnoty glykémie v plazmě žilní krve v tomto vzorku jsou testovaní zařazeni:
- glykémie < 7,8 mmol/L: normální glukózová tolerance;
- glykémie ≥ 11,1 mmol/L: diabetes mellitus;
- glykémie 7,8 – 11,0 mmol/L: porušená glukózová tolerance; v tomto případě se doporučuje oGTT po několika měsících zopakovat.
Algoritmus diagnostiky diabetu ilustruje následující obrázek (vysvětlení zkratek v textu).
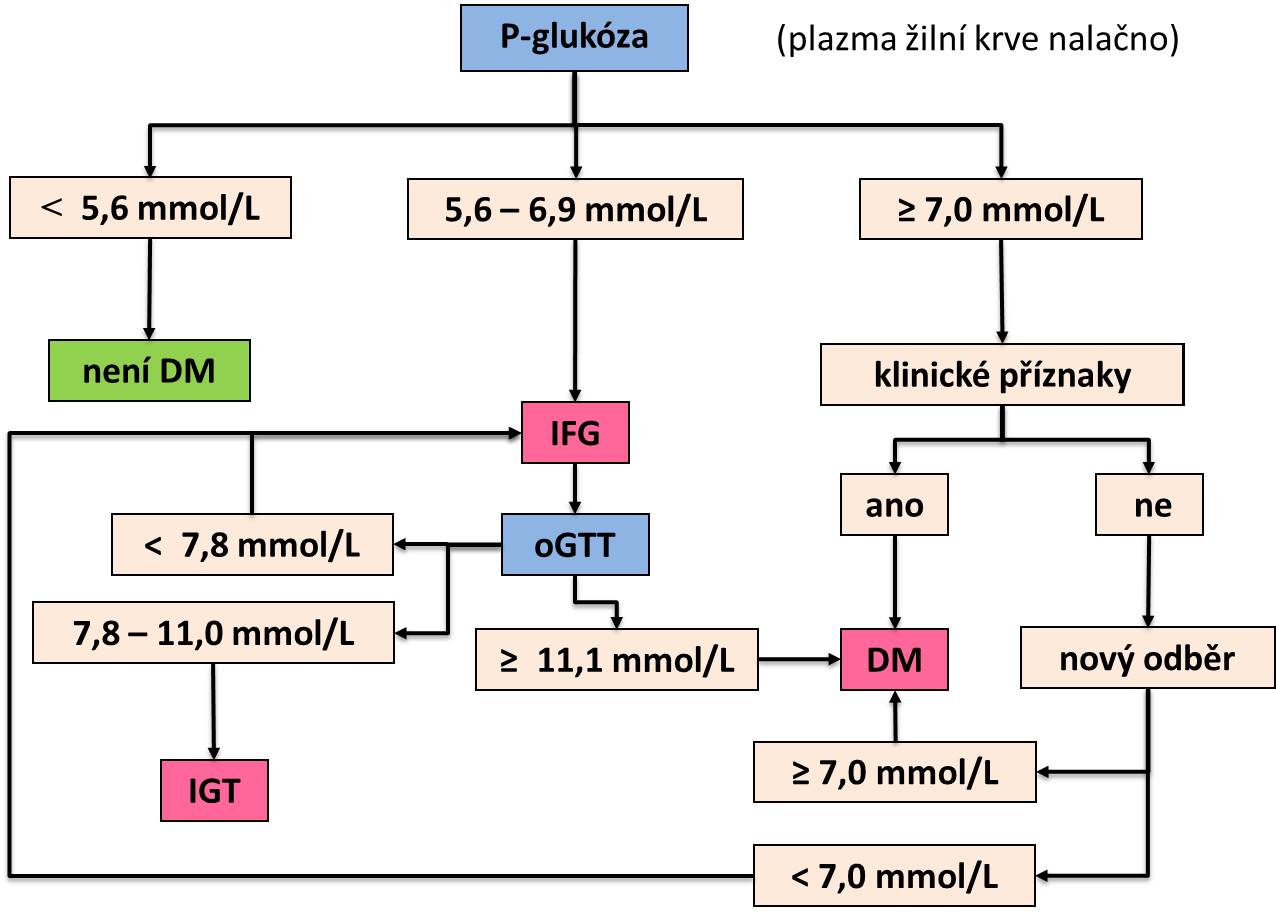
Screening gestačního diabetu
Screening gestačního diabetu (GDM) začíná v prvém trimestru měřením hladiny glukózy v žilní krvi nalačno; při normálním výsledku pokračuje provedením glukózového tolerančního testu (oGTT) v 2. trimestru, obvykle mezi 24. a 28. týdnem gravidity. Jeho provedení je stejné jako mimo těhotenství, krev na stanovení hladiny glukózy se však odebírá navíc 1 hodinu po podání 75 g glukózy p. os. (tj. tříbodový test) a poněkud přísnější jsou kritéria hodnocení testu. Koncentrace glukózy v séru (plazmě) venózní krve by měla být nalačno pod 5,1 mmol/L, hodinu po zátěži pod 8,5 mmol/L a dvě hodiny po ní pod 10 mmol/L; pro stanovení diagnózy GDM stačí, když je překročena jen jedna z těchto tří hodnot.
Je-li glykémie nalačno opakovaně ≥ 7,0 mmol/L, nejedná se o GDM, ale o zjevný diabetes mellitus v těhotenství. Podrobně postup při screeningu GDM popisuje následující obrázek.
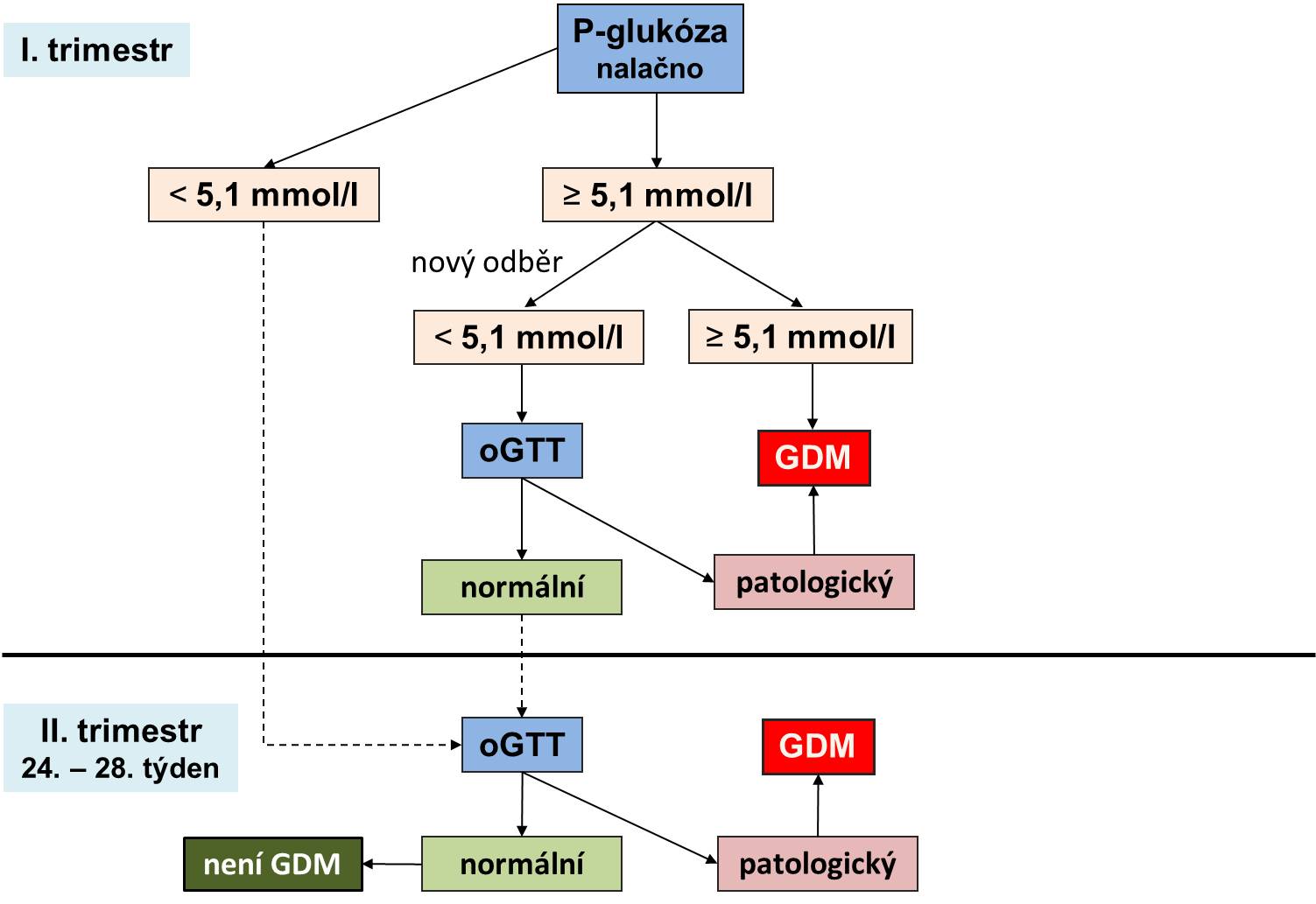
I když asi u 90 % případů gestačního diabetu (tj. diabetu diagnostikovaného v těhotenství) se po porodu normalizuje tolerance glukózy, jsou tyto ženy v budoucnu přece jen více ohroženy manifestací diabetu.
O diabetu v těhotenství a nutnosti správné kompenzace onemocnění pro matku i plod bylo pojednáno zde.
Poznámka: V USA je někdy jako screening gestačního diabetu mezi 24. a 28. týdnem gravidity prováděn tzv. Glucose challenge test: hladina glukózy se měří v plazmě žilní krve, odebrané 1 hodinu po podání roztoku s 50 g glukózy. Glykémie by měla být nižší než 7,8 mmol/L (někteří autoři doporučují 7,2 mmol/L); při překročení této hranice se provádí „klasický“ oGTT se 75 g glukózy p. o.
Prediabetes
Stav, který je indikací k provedení oGTT (tj. glykémie v plazmě žilní krve nalačno > 7,0 mmol/L nalezená jednou u osoby bez příznaků diabetu nebo glykémie v rozmezí 5,6 – 7,0 mmol/L) je nazýván hraniční glykémie nalačno (impaired fasting glucose, IFG). Ta je spolu s porušenou glukózovou tolerancí (impaired glucose tolerance, IGT, tj. glykémie v plazmě žilní krve ve 2. hodině oGTT v rozmezí 7,8 – 11,0 mmol/L) někdy označována jako prediabetes. Je nesporné, že tyto osoby mají vysoké riziko rozvoje diabetu. Navíc jsou ohroženy i kardiovaskulárními chorobami a zhoubnými nádory, mj. kolorektálním karcinomem.
8. Laboratorní kontrola diabetu
Je-li nemocnému diagnostikován diabetes mellitus, je zapotřebí jeho laboratorní kontrola. Podle doby, kterou laboratorní vyšetření pokrývá, rozlišujeme následující stupně kontroly.Jednorázová glykémie
Vyšetření ukazuje aktuální koncentraci glukózy v krvi v době odběru. Má význam především při podezření na významnou hyper- či hypoglykémii. Nemocný si může vyšetření provést sám po odběru krve z prstu pomocí diagnostických proužků a výsledek odečíst na osobním glukometru (self-monitoring) nebo se měření provádí přímo u lůžka (point-of-care testing, POCT) pomocí glukometrů, které se dají zapojit do sítě a výsledek předat do laboratorního informačního systému. Podle zjištěného výsledku je možná okamžitá reakce (podání inzulinu či naopak sacharidů).
Glykemický profil
Informuje o změnách hladiny glukózy v krvi v průběhu 24 hodin. Krev je odebírána z prstu v předem daných časech (5 – 9 odběrů za den). Nejedná se o vyšetření akutní, vzorky správně konzervované lze uchovávat a do laboratoře odeslat najednou. Podle zjištěných hodnot je řízena léčba inzulinem (typ inzulinu, intervaly, dávky).
Kontinuální monitorování glykémie
U diabetiků léčených intenzifikovaným inzulinovým režimem s neuspokojivou kompenzací, s hypoglykémiemi a/nebo labilním diabetem (včetně těhotných a dětských pacientů) je žádoucí kontinuální monitorování glykémie (CGM). K dispozici je větší množství přístrojů, které mají glukózový senzor umístěný v podkoží. Hladina glukózy je měřena každých pět minut; kromě zobrazení na displeji (nebo na mobilním telefonu a jiném obdobném přístroji) je množná nastavit alarm při hypo- či hyperglykémii a dokonce spojit monitorování s inzulinovou pumpou s možností její činnost na dálku zastavit. Protože přístroj měří koncentraci glukózy v tkáňovém moku a ne v krvi, je třeba počítat, že jím monitorované změny mají za změnami v krvi zpoždění asi 10 minut.
Dlouhodobá kompenzace diabetu – glykovaný hemoglobin
Ošetřující lékař potřebuje vědět, jaká byla kompenzace nemocného v delším časovém období. K tomu dnes slouží obvykle stanovení tzv. glykovaného hemoglobinu.
Glykace je neenzymová vazba molekul sacharidů na volné aminokyseliny biomolekul. Nejčastěji se váže molekula glukózy svou aldehydovou skupinou na volnou aminoskupinu bílkoviny, zejména ε-aminoskupinu lyzinu. V kondenzační reakci vzniká tzv. Schiffova báze (chemicky aldimin). Reakce je plně vratná: při hyperglykémii se glukóza váže na molekuly bílkovin, při poklesu glykémie se molekula glukózy zase odštěpí, reakce tedy proběhne opačným směrem.
Toto však platí jen tehdy, je-li hyperglykémie přechodná. Trvá-li dlouho (týdny), dochází k přestavbě molekuly aldiminu, hovoříme o intramolekulárním přesmyku (podle jeho objevitele se nazývá Amadoriho přesmyk). Tato reakce je již nevratná a dává vzniknout ketoaminu, což je vlastně derivát fruktosaminu. Fruktosamin zůstává vázán na molekulu bílkoviny až do její úplné degradace a eliminace z organismu. Stanovení glykovaného podílu krevních bílkovin, zejména hemoglobinu, umožňuje tak posoudit stav dlouhodobé kompenzace diabetika, tj. průměrnou glykémii za delší časové období. Schéma glykace znázorňuje následující obrázek (vysvětlení v textu).
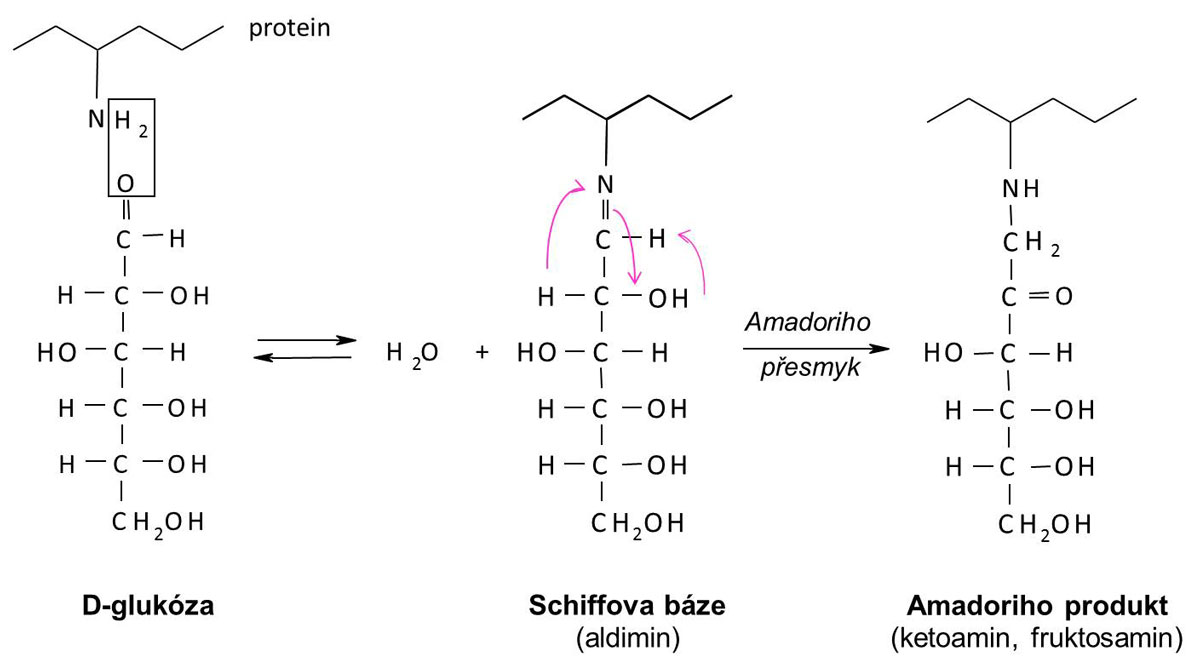
- beta-řetězec hemoglobinu A je snadno glykován,
- glukóza proniká do erytrocytů i bez účinku inzulinu – hemoglobin je dostupný glykaci i u diabetika,
- hemoglobin má velmi dlouhý biologický poločas.
Stanovujeme tedy glykovaný hemoglobin, zkratkou obvykle označovaný jako HbA1c či jen A1c.
Glykovaný hemoglobin ukazuje kompenzaci nemocného (průměrnou glykémii) asi 2 – 3 měsíce před odběrem krve.
Do r. 2004 se pro vyjadřování výsledku užívala procenta z celkového hemoglobinu, stanovení provádělo podle National Glycohemoglobin Standardization Program (NGSP); za dobrou kompenzaci diabetu se považovala hodnota < 6,5 %. Tato kalibrace je dosud užívána v USA. Od r. 2004 se užívala jiná kalibrace podle International Federation of Clinical Chemistry (IFCC); dává hodnoty přibližně o 2 % nižší a byla přijata většinou evropských zemí včetně České republiky. Konečně od r. 2011 se k vyjadřování koncentrace glykovaného hemoglobinu užívají SI jednotky, vyjadřující množství molekul fruktosaminu navázaných na molekulu hemoglobinu; jednotkou je mmol/mol. Platí následující vztahy:
- IFCC (%) = 1,093 NGSP (%) – 2,152
- NGSP (%) = 0,09148 IFCC + 2,152
- SI (mmol/mol) = IFCC (%) x 10
Horní referenční mez glykovaného hemoglobinu je 42 mmol/mol, dobře kompenzovaný diabetik má hodnoty mezi 43 – 53 mmol/L, vyšší hodnoty signalizují dekompenzaci diabetu a měly by být signálem ke změně terapie a režimu.
Glykovaný hemoglobin v diagnostice diabetu
V USA a některých dalších státech lze využít koncentraci glykovaného hemoglobinu i k diagnostice diabetu. V porovnání s diagnostikou pomocí glykémie má několik výhod; patří k nim:
- lepší analytické parametry;
- vyšší stabilita analytu ve vzorcích biologického materiálu;
- nižší biologická variabilita HbA1c (pod 2 %);
- vyšší komfort pro pacienta (odpadá nutnost lačnění a pití roztoku glukózy);
- minimální vliv stresu na výsledek;
- použití identického vyšetření k diagnóze i ke kontrole terapie.
Skupina expertů z ADA (American Diabetes Association), EASD (European Association for the Study of Diabetes) a IDF (International Diabetes Federation) doporučuje jako „cut-off“ hodnotu glykovaného hemoglobinu pro diagnostiku diabetu 6,5 % (NGSP); tomu odpovídá podle kalibrace IFCC hodnota 49 mmol/mol. Hodnota od 38 do 48 mmol/mol pak ukazuje na zvýšené riziko rozvoje diabetu, resp. jeho pozdních komplikací. Bylo totiž zjištěno, že poměrně dobře koreluje hodnota glykovaného hemoglobinu a riziko pozdních komplikací, zejména diabetické retinopatie. Protože se (stejně jako u diagnostiky diabetu pomocí glykémie) jedná o spojitou funkci a nelze určit hodnotu, od které by riziko výrazněji stoupalo, jsou příslušné limity zvoleny dohodou – aby bylo odhaleno dostatečné množství nemocných a současně jim mohla být poskytnuta kvalifikovaná péče.
Opakovaně byla srovnávána diagnostika diabetu podle klasických kritérií (glykémie nalačno a postprandiální, výsledek oGTT) a podle nově zavedeného kritéria, hodnoty glykovaného hemoglobinu. Lze říci, že každé z kritérií zahrnuje poněkud odlišnou část populace a že se překrývají jen zčásti (následující obrázek), přičemž glukózový toleranční test se zdá být citlivější v detekci diabetu než stanovení glykovaného hemoglobinu. Výše uvedené důvody však opravňují zařadit glykovaný hemoglobin jako rovnocenné kritérium diagnostiky diabetu, což se uplatní zejména u osob, které nezaručují dodržení správné přípravy na oGTT.
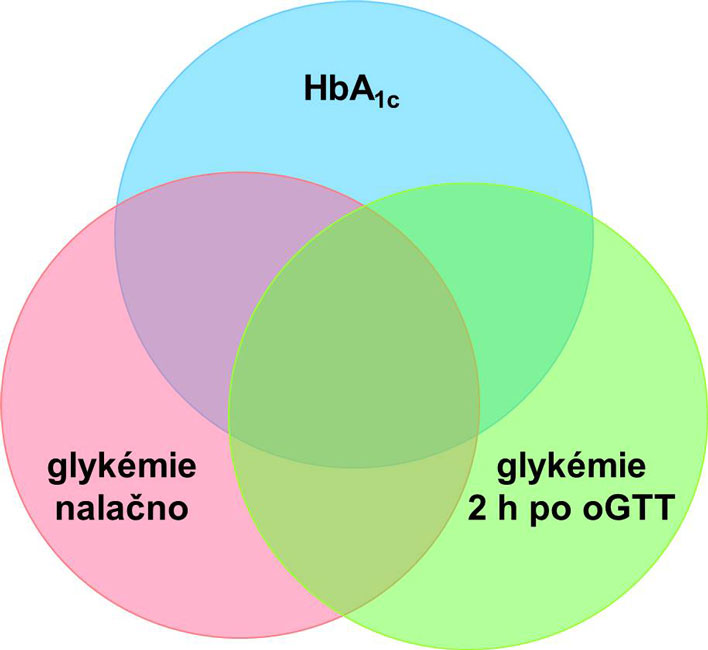
Podle doporučení České diabetologické společnosti a České společnosti klinické biochemie je v případě pochybnosti rozhodující pro stanovení diagnózy diabetu výsledek glukózového tolerančního testu (oGTT). Stanovení glykovaného hemoglobinu se užívá pouze k hodnocení dlouhodobé kompenzace diabetu; v případě, že se nejde zvýšená hodnota glykovaného hemoglobinu u nemocného bez diagnózy diabetes mellitus je třeba potvrdit (či vyloučit) diabetes pomocí glykémie.
Stanovení glykovaného hemoglobinu
Mezi metody, umožňující stanovení glykovaného hemoglobinu, patří kapilární elektroforéza, afinitní nebo ionexová kapalinová chromatografie (na jednoúčelových přístrojích) a imunoanalytické metody, kde lze užít automatický analyzátor. Nejlepší analytické vlastnosti ukazuje kapilární elektroforéza.
Glykovaný albumin
Kdysi byl jako ukazatel střednědobé kompenzace diabetu stanovován tzv. glykovaný protein; test byl znám pod názvem fruktosamin. Stanovoval hlavně glykovanou molekulu albuminu. Protože se však jednalo o nespecifickou metodu s řadou interferencí, byla postupně opuštěna.
V poslední době bylo vyvinuto několik specifických metod, stanovující výhradně glykovaný albumin. Slouží jako ukazatel kompenzace nemocného 2 – 4 týdny před odběrem krve a může být užit v případech, kdy glykovaný hemoglobin nedává spolehlivou informaci o dlouhodobé kompenzaci diabetu (zkrácené přežívání erytrocytů, hemoglobinopatie apod.).
POCT u diabetu, selfmonitoring nemocného
Existuje možnost kontroly diabetika v ordinaci lékaře, na operačním sále či doma samotným pacientem. Bez možnosti kontroly glykémie a okamžité reakce na zjištěnou hodnotu si již nedovedeme představit péči o diabetiky.
Již desítky let jsou k dispozici osobní glukometry, které objektivně vyhodnotí glykémii stanovenou pomocí diagnostického proužku. Nejmodernější přístroje pracují na elektrochemickém principu a mají možnost uchovat v paměti množství výsledků. Pro správné měření je třeba edukovat nemocného (nebo nelaboratorní zdravotnický personál); glukometry umístěné ve zdravotnickém zařízení by měly být zařazeny do systému externího hodnocení kvality. Považuji za nutné zdůraznit, že glukometry slouží ke kontrole diabetika a nikoliv pro diagnostiku onemocnění; ve srovnání se sofistikovanými metodami stanovení glykémie v klinických laboratořích totiž vykazují výsledky významně horší reprodukovatelnost (povolená celková chyba měření je ± 15 % při hodnotě glykémie ≥ 5,6 mmol/L a ± 0,8 mmol/L při glykémii < 5,6 mmol/L).
V poslední době jsou nabízeny i další možnosti vyšetřování diabetika formou POCT. Je to především stanovení glykovaného hemoglobinu; bohužel však řada přístrojů pro tento účel vyráběných nevykazuje přijatelné analytické parametry. Stanovení středně zvýšené albuminurie (nesprávně zvané mikroalbuminurie) speciálním proužkem (nikoliv proužkem pro průkaz proteinurie!) je rovněž možné; protože se však v žádném případě nejedná o vyšetření akutní, je vhodnější, aby toto vyšetření bylo svěřeno příslušné klinické laboratoři.
9. Stanovení inzulinu a C-peptidu
Jak inzulin, tak i C-peptid lze stanovit imunochemickými metodami za pomoci specifických protilátek, v praxi se však běžně neužívají. Protože β-buňky pankreatu secernují inzulin i C-peptid v ekvimolárním množství, lze považovat C-peptid za ukazatel endogenní sekrece inzulinu. Na rozdíl od stanovení inzulinu není hladina C-peptidu ovlivněna exogenním inzulinem a event. přítomnými antiinzulinovými protilátkami. Stanovení C-peptidu má tedy význam pro posouzení reziduální sekrece inzulinu u nemocných s diabetem 1. typu, svůj význam má i u hypoglykémie nejasné etiologie. Vznik C-peptidu z proinzulinu byl popsán v této kapitole.Kvantifikace inzulinové rezistence
Inzulinová rezistence je typická nejen pro diabetes mellitus 2. typu, ale i pro tzv. metabolický syndrom. Zejména pro hodnocení léčebných opatření je někdy třeba objektivizovat inzulinovou rezistenci a hodnotit její stupeň. Slouží pro to několik způsobů, z nichž však žádný nepatří k rutinním vyšetřením.
HOMA (Homeostatic Model Assessment) index se počítá ze sérové koncentrace glukózy a inzulinu nalačno.
Inzulinová křivka – jde vlastně o orální glukózový toleranční test, prodloužený na tři hodiny po perorálním podání glukózy. Inzulinová rezistence se projeví nadprodukcí inzulinu, tedy hyperinzulinismem.
Euglykemický hyperinzulinemický clamp je provedením nejsložitější. Testovanému je v i. v. infuzi podáván stále stejnou rychlostí inzulin a současně dostává infuzi s glukózou. Její rychlost se mění tak, aby se hodnota glykémie pohybovala mezi 5–5,5 mmol/L. Inzulinová rezistence se projeví sníženým množstvím glukózy, které je potřebné podat pro udržení euglykémie.
10. Stanovení autoprotilátek
Diabetes mellitus 1. typu je autoimunitní onemocnění, způsobené destrukcí β-buněk cytotoxickými T-lymfocyty. Zároveň však u těchto nemocných můžeme prokázat v krevním séru různé typy s diabetem asociovaných autoprotilátek; ty sice nemají cytotoxický účinek, signalizují však probíhající autoimunitní proces. Velmi příhodně je účinek cytotoxických lymfocytů přirovnáván k ohni, zatímco autoprotilátky představují pouze kouř, který k ohni patří, ale sám nemá ničivý účinek.Autoprotilátky bývají prokazatelné měsíce až roky před propuknutím klinických příznaků: musí být totiž zničeno více než 90 % β-buněk, aby byla produkce inzulinu tak nízká, že vede k příznakům diabetu. Při dalším průběhu diabetu pak autoprotilátky často postupně mizí.
V praxi se prokazují následující autoprotilátky se vztahem k DM1:
- autoprotilátky proti buňkám Langerhansových ostrůvků (islet cells autoantibodies, ICA);
- autoprotilátky proti inzulinu (insulin autoantibodies, IA);
- autoprotilátky proti glutamátdekarboxyláze (glutamic acid dexarboxylase autoantibodies, GADA);
- autoprotilátky proti intracelulární části tyrozinfosfatázy (insulinoma 2-associated autoantibodies, IA-2A);
- autoprotilátky proti specifickému transportéru zinku (zinc transporter 8 protein islet autoantibodies, ZnT8A)
Kromě inzulinu jsou všechny antigeny, proti kterým se autoprotilátky tvoří, lokalizovány intracelulárně, musí proto probíhat destrukce β-buněk, aby se antigeny zpřístupnily imunokompetentním buňkám.
ICA a GADA jsou prokazatelné u 70 – 80 % osob s DM1 v době nástupu onemocnění, další typy autoprotilátek mají o něco menší senzitivitu. Nález autoprotilátek představuje zvýšené riziko rozvoje DM1 v budoucnu; riziko přitom roste s počtem typů detekovaných protilátek, popisuje se přibližně 3, 16, 40 a 50% riziko u nálezu 1, 2, 3 a 4 typů autoprotilátek. Riziko dále zvyšuje nález DM1 v příbuzenstvu nebo přítomnost rizikového HLA genotypu.
Dá se předpokládat, že stanovení autoprotilátek bude mít velký význam u příbuzných osob s DM1 v době, kdy budeme schopni preventivní léčbou tlumit autoimunitní proces a oddálit tak nástup onemocnění.
Jak bylo uvedeno, diabetes mellitus 1. typu je autoimunitní onemocnění. Protože se autoimunitní onemocnění často sdružují, doporučuje se pomýšlet na možnost DM1 i u osob s diagnostikovaným jiným autoimunitním onemocněním (celiakie, autoimunitní thyreoiditida apod.). Naopak u nemocných s DM1 myslíme i na možnost přítomnosti jiných autoimunitních chorob.
11. Komplikace diabetu
Diabetes mellitus je závažný především svými závažnými komplikacemi, které mohou být až život ohrožující. Mohou nastoupit rychle a rozvíjejí se během hodin až dnů, někdy dokonce během desítek minut (akutní komplikace diabetu), jindy je třeba desítky let trvání nemoci, aby se komplikace projevily (komplikace pozdní, chronické). V dalších odstavcích tyto komplikace stručně probereme, hlavně s ohledem na jejich vztah k laboratorním vyšetřením; pro podrobnosti odkazujeme na interní medicínu.Akutní komplikace diabetu
Tyto komplikace vznikají náhle a mohou bezprostředně ohrozit nemocného na životě. V podstatě rozlišujeme následující akutní komplikace diabetu.
Diabetická ketoacidóza
Příčinou je nedostatek inzulinu. Postihuje častěji diabetiky 1. typu, kde je absolutní nedostatek inzulinu, ale nevyhýbá se ani diabetikům 2. typu. Nemocný má významnou hyperglykémii, močí ztrácí velké množství tekutin, ale i minerálů (osmotická diuréza), může nastat až šokový stav. Roste osmolalita plazmy. Při vysoké glykémii je z osmotických důvodů nasávána voda z buněk; to může vést k hyponatrémii, která při poklesu glykémie během léčby pacienta zase ustupuje. Nemožnost buněk metabolizovat glukózu vede k oxidaci mastných kyselin a tvorbě ketolátek. Hyperglykemické kóma nacházíme u diabetické ketoacidózy s významným poklesem pH krve, těžkou dehydratací, šokem a vyčerpáním. V moči prokazujeme ketolátky. U nemocných v šokovém stavu může hypoxie tkání vést k redukci kyseliny acetoctové na kyselinu β-hydroxymáselnou, která s diagnostickým proužkem na průkaz ketolátek nereaguje; ty pak vycházejí falešně negativní.
Příčinou vzrůstající metabolické acidózy může být i hromadění laktátu: osmotická diuréza totiž působí značnou dehydrataci nemocného s hyperosmolalitou a následnou centralizací krevního oběhu. Vzniká tak až šokový stav s hypoperfuzí a hypoxií periferních tkání; laktát je konečným produktem anaerobní glykolýzy. Hypoxie tkání vede nejen k tvorbě a hromadění laktátu, ale i k redukci kyseliny acetoctové na β-hydroxymáselnou; ta však neposkytuje reakci s běžnými činidly na stanovení ketolátek. Po rehydrataci pacienta a obnově periferní cirkulace, a tím i oxygenace tkání, tak může paradoxně dojít k vyššímu nálezu ketolátek v moči, danému reoxidací kyseliny β-hydroxymáselné. O příčině acidózy u diabetika tedy nejlépe vypovídají dvě metody: přímé stanovení kyseliny β-hydroxymáselné a mléčné v plazmě. Laktátová acidóza se u diabetiků 2. typu může vyvinout i při léčbě biguanidy (metformin).
Kompenzace ketoacidózy se projeví velkým Kussmaulovým dýcháním, z dechu nemocného může být cítit aceton. U nemocných v šokovém stavu se na rozvoji acidózy podílí i nadprodukce laktátu v hypoxických tkáních.
Při terapii diabetické ketoacidózy je zapotřebí kromě inzulinu přiváděného intravenózně zajistit rehydrataci a remineralizaci nemocného. Je třeba počítat s tím, že normalizace glykémie je doprovázena přesunem vody do intracelulárního prostoru, a tedy zahuštěním extracelulární tekutiny. Příliš razantní léčba může vést k rychlému poklesu osmolality v extracelulární tekutině a hrozí influx vody do CNS a edém mozku. Další možnou komplikací může být hypokalémie následkem vstupu draslíku do buněk. Konečně je nutné hlídat pH krve: metabolismus ketolátek vede ke vzestupu koncentrace hydrogenuhličitanů a hrozí alkalémie se všemi negativními důsledky. Počáteční alkalizaci tedy provádíme jen výjimečně; před přílišným vzestupem pH krve chrání i infúze NaCl, event. KCl.
Hyperglykemické hyperosmolární kóma
U osob s diabetem 2. typu se častěji vyskytuje hyperosmolální kóma bez acidózy; v popředí je hyperglykémie a dehydratace nemocného s hyperosmolalitou tělesných tekutin. K hyperosmolálnímu kómatu dochází častěji u nemocných s diabetem 2. typu, kteří mají zachovánu určitou bazální sekreci inzulinu. Ta sice stačí zabránit tvorbě ketolátek, nemusí však být dostatečná pro zajištění transportu veškeré glukózy do buněk. Vyvolávajícím faktorem bývá nejčastěji infekce, např. pneumonie. Základem léčby je pozvolná hydratace a léčení vyvolávající příčiny (infekce), často bývá nutná léčba inzulínem.
Hypoglykemické kóma
Hypoglykemické kóma je obvykle vyvoláno předávkováním inzulinu (podání nadměrné dávky, nedostatečný přívod sacharidů či nezvyklá fyzická zátěž při normální dávce inzulinu). Příznaky jsou tím těžší, čím rychleji glykémie klesá. Pocení je vyvoláno aktivací sympatiku, následuje porucha vědomí až kóma – buňky CNS potřebují pro svou činnost glukózu. Léčba spočívá v přívodu glukózy p. os či i. v. u nemocného v bezvědomí. Hypoglykémie rozdělujeme na „lehké“ – pacient si pomůže sám požitím sacharidů a „těžké“ pacient potřebuje pomoc druhé osoby.
Výjimečně se může těžkou hypoglykémií projevit i předávkování perorálních antidiabetik ze skupiny derivátů sulfonylurey.
Ukazuje se, že nejen hyperglykémie, ale i opakující se hypoglykémie zvyšují kardiovaskulární riziko diabetika.
Pozdní (chronické) komplikace diabetu
Pozdní komplikace ohrožují diabetiky 1. i 2. typu. Rozvíjejí se postupně, desítky let a zpočátku se neprojevují žádnými příznaky. Jak již bylo uvedeno v úvodu, 20 – 30 % nově diagnostikovaných nemocných má již rozvinuté pozdní komplikace. Protože nejdůležitější je prevence pozdních komplikací, je jasné, jak velký význam má co nejčasnější stanovení diagnózy diabetu.
Pozdní komplikace postihují zejména drobné cévy (mikroangiopatie), ale i velké cévy (makroangiopatie). Diabetes mellitus představuje významný rizikový faktor kardiovaskulárních chorob; většina diabetiků spadá do kategorie vysokého či dokonce velmi vysokého kardiovaskulárního rizika.
Rozlišují se hlavní dva typy cévních komplikací diabetu: diabetická makroangiopatie a diabetická mikroangiopatie.
Diabetická makroangiopatie je charakteristická postižením velkých tepen a onemocnění se nijak neliší od aterosklerózy osob, které nemají diabetes. Rozdíl je jen v tom, že diabetici jsou v průměru 3krát více ohroženi než osoby bez diabetu. Nemocný je ohrožen všemi známými komplikacemi aterosklerózy: různými formami ischemického onemocnění srdce včetně infarktu myokardu, cévní příhodou mozkovou i komplikacemi postižení velkých tepen dolních končetin.
V etiopatogenezi aterosklerózy se uplatňuje především oxidační stres; nadprodukce volných radikálů u diabetiků doprovází hyperglykémii, glykace LDL částic usnadňuje jejich oxidaci a neschopnost vazby na LDL receptory.
Diabetická mikroangiopatie je u diabetiků typická komplikace. Postiženy jsou drobné tepénky, jejich stěna zesílí a následují poruchy oxygenace tkání. Nejzávažnější je postižení cév očního pozadí (diabetická retinopatie, vedoucí až k slepotě), glomerulů (diabetická nefropatie, končící selháním ledvin), cév dolních končetin s následnými gangrénami. Postižení cév zásobujících nervy se podílí na vzniku diabetické neuropatie.
V etiopatogenezi této komplikace se uplatňuje glykace proteinů s dlouhým biologickým poločasem a následnou oxidací vzniklých sloučenin. Výsledkem je tvorba vysoce reaktivních aldehydů, zvaných advanced glycation end-products (AGE látky). Ty reagují s dalšími bílkovinami a glukóza tak vytváří můstky mezi jednotlivými bílkovinnými molekulami. Zesítěné bílkoviny mají stimulační účinek na tvorbu cytokinů se zánětlivým a proliferačním účinkem; jejich působením se mění charakter a tloušťka cévní stěny a vzniká tak diabetická mikroangiopatie.
Z etiopatogeneze procesu je jasné, že nejúčinnější prevencí bude co nejlepší kompenzace diabetika, bránící nadměrné glykaci i nadprodukci volných radikálů.
Albuminurie – včasné rozpoznání hrozící diabetické nefropatie
Zdravým glomerulem prochází jen minimální množství albuminu (glomerulární membrána má fyziologicky negativní náboj stejně jako albumin) a jisté množství mikroproteinů. Tyto bílkoviny jsou téměř kompletně vychytány buňkami proximálního tubulu a odbourány. Resorpční schopnost proximálního tubulu však nemá velkou funkční rezervu a při zvýšeném průniku bílkovin glomerulární membránou jsou neresorbované proteiny prokazatelné v moči. Tak je tomu i v počáteční fázi diabetu, kdy přechodně pozorujeme glomerulární hyperfiltraci. V moči se pak najde zvýšené množství albuminu – větší než fyziologické, i když ještě neprokazatelné testačními proužky na průkaz bílkoviny. Tento stav se nazýval "mikroalbuminurií"; správnější termín je středně zvýšená albuminurie; v diabetologické praxi se však pro svou délku nevžil. K jejímu průkazu je třeba použít citlivější, imunochemickou metodu. Následující obrázek vysvětluje pojem „mikroalbuminurie“; v praxi se však vzhledem k závislosti koncentrace albuminu v moči na hydrataci nemocného nevydává výsledek v mg/L, ale v jednotkách beroucích tento fakt v úvahu (viz dále).

U diabetiků slouží vyšetření „mikroalbuminurie“ k časné predikci diabetické nefropatie. Pacienti s diabetem by měli být testováni na přítomnost diabetického onemocnění ledvin jednou ročně. Screening by měl začít u pacientů s diabetem 1. typu 5 let po stanovení diagnózy diabetu a u pacientů s diabetem 2. typu ihned po stanovení diagnózy. Screening zahrnuje stanovení poměru albumin/kreatinin v prvním ranním nebo náhodném vzorku moči. Vyšetření albuminu v moči sbírané 24 hodin se nedoporučuje, je však možné vyšetřit albuminurii ve vzorku moči sbíraném během klidu na lůžku v noci; výsledek je pak vydáván v μg/min. V praxi se však dává přednost vyšetření v jednorázovém vzorku moči, výsledek se vztahuje ke koncentraci kreatininu v moči (albumino-kreatininový kvocient, ACR = albumin/creatinine ratio) a vydává se v g albuminu/mol kreatininu); hodnocení albuminurie shrnuje Tabulka níže. Vzhledem k vysoké intraindividuální variabilitě (až 30 %) by pro diagnózu „mikroalbuminurie“ měly být pozitivní alespoň 2 ze 3 vzorků moče vyšetřených v průběhu 3 – 6 měsíců; vyšetření by nemělo být prováděno při současné infekci močových cest, po zvýšené fyzické námaze a při menses. Diabetické onemocnění ledvin je přítomno ve formě incipientní diabetické nefropatie vždy, je-li prokázána „mikroalbuminurie“.
Kritéria mikroalbuminurie.
| Typ vzorku | "Mikroalbuminurie" |
|---|---|
| Náhodný vzorek | 3,0 – 30,0 g/mol kreatininu |
| Sběr moči | 30 – 299 mg/24 h 20 – 199 μg/min |
Poznámka: Preferovaným kritériem je hodnota ACR (g/mol kreatininu)
Zlepšení metabolické kompenzace diabetu, uspokojivá korekce hypertenze a léčba inhibitory angiotenzin konvertujícího enzymu (ACEI) snižuje riziko progrese postižení ledvin. Pacienti s „mikroalbuminurií“ (i nediabetici) mají výrazně zvýšené kardiovaskulární riziko. Mikroalbuminurie je u těchto nemocných zřejmě markerem generalizované endotelové dysfunkce. V poslední době se ukazuje, že zvýšené renální i kardiovaskulární riziko mají i osoby s tzv. vysokou normální albuminurií.
Měření koncentrace albuminu v moči je důležité i u nemocných s arteriální hypertenzí, kde rovněž může signalizovat počínající poškození ledvin.
12. Možnosti léčby diabetu
Cílem těchto odstavců není suplovat učebnici vnitřního lékařství, ale přinést stručný přehled možností léčby diabetika se zdůrazněním mechanismu účinku jednotlivých možností z pohledu biochemika.Dieta
U diabetiků se uplatňuje dieta s určitým omezením sacharidů, avšak jen v počátečních stadiích diabetu 2. typu. Dieta vedoucí ke snížení hmotnosti u nemocných s centrální obezitou významně zvyšuje citlivost k inzulinu, neboť omezí nadprodukci cytokinů tukovou tkání. Samozřejmou součástí terapie je i zvýšení tělesného pohybu.
Někdy se u potravin obsahující sacharidy uvádí tzv. glykemický index; ukazuje rychlost nárůstu glykémie a délku jejího přetrvávání po perorálním příjmu potravy s obsahem sacharidů. Stanoví se průběh glykémie během dvou hodin po jídle obsahujícím 50 g sacharidů (v jakékoli formě) a stejně tak po podání 50 g glukózy per os. Poměr plochy pod křivkou u testované stravy a roztoku samotné glukózy vyjádřený v procentech je glykemický index. Potraviny s vysokým glykemickým indexem (ovoce, med, bílé pečivo) působí rychlý nárůst glykémie, zvýšenou sekreci inzulinu, zvyšují tkáňovou rezistenci na inzulin a stoupá po nich koncentrace triacylglycerolů. Naproti tomu potraviny s nízkým glykemickým indexem (luštěniny, ovoce) nemají výše uvedené nepříznivé metabolické účinky, a jejich podávání diabetikům se proto jeví jako výhodnější.
Medikamentózní terapie
K dispozici je celá řada léků s různou indikací i odlišným mechanismem účinku.
Inzulin
Dnes se užívá výhradně humánní inzulin, vyráběný pomocí biotechnologických metod. Indikován je u nemocných s DM1 a v pokročilejších stadiích a při komplikacích u nemocných s DM2. Je k dispozici řada preparátů lišících se rychlostí nástupu a přetrváváním účinku. Běžné je podávání podkožní, často inzulinovými pery, v případě potřeby i inzulinovou pumpou.
Inzulinová analoga
Jedná se o zvláštně upravený inzulin, jehož molekuly se liší od humánního inzulinu v uspořádání aminokyselin. Změnou struktury inzulinu je dosažena změna rychlosti a délky účinku inzulinu. Krátkodobě působící mají kratší dobu působení, ale rychlejší dobu nástupu než klasický humánní inzulin. Používají se nejen injekčně, ale i do inzulinových pump. Dlouhodobě působící analoga mají výhodu v dlouhodobém působení (až 36 hodin). Platí pravidlo: čím déle analog působí, tím má nižší riziko vzniku hypoglykémie. Inzulínová analoga používá v ČR 90 % osob s diabetem.
Biguanidy
Metformin je jediným široce používaným zástupcem této skupiny a je doporučován jako první lék společně s dietou u všech recentně diagnostikovaných diabetiků. Zvyšuje senzitivitu jater a svalové tkáně i inzulinu, tlumí glukoneogenezu i vstřebávání glukózy v tenkém střevě. Stimulací glykolýzy mohou vyvolat vznik laktátové acidózy u osob v renální insuficienci.
Deriváty sulfonylurey
Patří mezi tzv. inzulinová sekretagoga, zvyšují totiž sekreci inzulinu z beta β-buněk Langerhansových ostrůvků. Základním mechanismem účinku je blokáda ATP-senzitivních kaliových kanálů, vedoucí k depolarizaci buněčné membrány. Při předávkování mohou vyvolat hypoglykémii, zvyšují chuť k jídlu a někdy vedou k nárůstu hmotnosti. Léky této skupiny jsou levné, ale vzhledem k riziku hypoglykémie jsou méně a méně používány především u kardiovaskulárně kompromitovaných osob.
Inhibice vzniku glukózy ze škrobu v tenkém střevě
Základním představitelem je akarbóza, inhibitor střevní α-glukosidázy. Tento enzym, který je vázán na povrch sliznice tenkého střeva, navazuje na činnost α-amylázy a dokončuje štěpení škrobu až na glukózu. Akarbóza tedy zpomaluje vznik glukózy z polysacharidů potravy a snižuje postprandiální hyperglykémii.
Glitazony
Glitazony (thiazolidindiony) aktivují prostřednictvím jaderného receptoru PPAR-γ transkripci genů, odpovídajících za metabolické účinky inzulinu, snižují tedy inzulinovou rezistenci. V Evropě je k dispozici pouze pioglitazon.
Glinidy
Glinidy, podobně jako deriváty sulfonylurey, blokují ATP-senzitivní kaliový kanál v membránách β-buněk. Působí rychle, takže jsou ideální k užívání s jídlem ke kompenzaci postprandiální hyperglykémie. Příkladem těchto látek je repaglinid a nateglinid. Mohou vyvolat hypoglykémii.
Léky modulující účinky inkretinů
Inkretiny jsou peptidy uvolňované z trávicího traktu, které napomáhají dosažení glukózové homeostázy. Hlavními inkretinovými hormony jsou glukagon-like peptid 1 (GLP-1) a glukóza-dependentní inzulinotropní polypeptid (GIP). GLP-1 stimuluje sekreci inzulinu po příjmu potravy, inhibuje sekreci glukagonu a zpomaluje vyprazdňování žaludku. Vede tím k výraznému snížení výkyvů glykémie po jídle.
V praxi se užívají syntetická analoga GLP-1, např. exenatid, liraglutid, dulaglutid. Jedná se o preparáty, které je nutné aplikovat podkožně. V současné době používaný dulaglutid stačí aplikovat 1x týdně. Jedná se o dražší léky, které jsou však na vzestupu vzhledem k účinnosti a minimu vedlejších účinků. Léčba vede ke snížení hmotnosti a nevznikají při ní hypoglykémie.
Další možností jak zvýšit hladinu GLP-1 je zpomalit jeho odbourávání enzymem dipeptidylpeptidázou 4 (DPP4). Výhodou inhibitorů DPP4 je možnost perorálního podávání a minimum vedlejších účinků. Při léčbě nedochází k nárůstu hmotnosti, ani ke vzniku hypoglykémie. Mezi jejich představitele patří sitagliptin a vildagliptin.
Glifloziny
Glifloziny jsou inhibitory glukózového transportéru SGLT2, který je zodpovědný za 90 % resorpce glukózy v proximálním tubulu ledvin. Jedná se tedy o cílené indukování glykosurie, klesá glykémie, glykovaný hemoglobin a posléze i tělesná hmotnost. Protože vstřebávání glukózy v tubulech ledvin je společné s resorpcí Na (tzv. symport), zvyšují se renální ztráty natria a tím i vody. Snížení hydratace vede k poklesu krevního tlaku. Glifloziny se mohou kombinovat s jinými antidiabetiky, např. metforminem. Zvýšené ztráty glukózy v moči mohou mít za následek vyšší frekvenci urogenitálních infekcí, méně často i vznik diabetické ketoacidózy. Příkladem jsou dapagliflozin, empagliflozin a canagliflozin. V poslední době se ukazuje, že tyto léky významně snižují kardiovaskulární mortalitu i morbiditu u diabetiků v sekundární prevenci. Glyfloziny vedou rovněž ke zpomalení progrese renální insuficience u diabetické nefropatie.
Transplantace buněk Langerhansových ostrůvků
V podstatě je možná transplantace samotného pankreatu (výjimečně), kombinovaná transplantace ledviny a pankreatu u nemocného s diabetem a selháním ledvin nebo transplantace samotných buněk Langerhansových ostrůvků. Té předchází složitá separace těchto buněk, čištění a množení v tkáňové kultuře. Samotný výkon je již jednodušší – buňky se aplikují injekčně do hlavní žíly vedoucí do jater, není tedy třeba operace.
V experimentu byly pokusným zvířatům intraperitoneálně aplikovány β-buňky enkapsulované v polymeru, umožňujícím průnik malých (glukóza) i středních molekul (inzulin), bránící však v přístupu protilátkám a imunokompetentním buňkám. Podařilo se tak kompenzovat experimentálně navozený diabetes mellitus po řadu měsíců.
13. Ostatní příčiny hypo- a hyperglykémie
K možným příčinám hypoglykémie patří:- delší lačnění u osob se sníženou zásobou glykogenu v játrech (novorozenci, zejména nedonošení, dále cirhotici);
- endokrinopatie (hypothyreóza, nedostatečnost nadledvin, nedostatek β-buněk pankreatu, hypopituitarismus aj.);
- poruchy absorpce glukózy ve střevě (sprue, steatorea, celiakie); perorální podání akarbózy;
- předávkování inzulinu – příliš velká dávka vzhledem k příjmu glycidů;
- velká fyzická námaha;
- předávkování perorálních antidiabetik (deriváty sulfonylurey);
- intoxikace alkoholem – hromadící se NADH inhibuje glukoneogenezu;
- novorozenci diabetických matek – po porodu přestává přísun glukózy přes placentu, přetrvává však zvýšená produkce inzulinu;
- nesidiom pankreatu (= inzulinom) – nádor β-buněk Langerhansových ostrůvků, hypoglykémie může být záchvatovitá;
- hereditární onemocnění, např.
- glykogenóza 1. typu (nalačno pro neschopnost nemocných štěpit jaterní glykogen);
- galaktosémie, intolerance fruktózy (po příjmu příslušného cukru).
Fyziologicky klesá glykémie v těhotenství, ve spánku, po značné fyzické námaze, při hladovění, postprandiální hypoglykémie následuje zejména po jídle bohatém na sacharidy.
Z příčin hyperglykémie podrobněji zmíníme relativně častou stresem indukovanou hyperglykémii. Inzulin je jediný hormon, snižující glykémii. Naproti tomu existuje množství hormonů, které mají opačný, tedy hyperglykemizující účinek. Při převaze těchto hormonů nad inzulinem dochází k hyperglykémii. Nejčastější je hyperglykémie vyvolaná nadprodukcí tzv. stresových hormonů.
Při stresu je nutné zajistit dostatek snadno využitelné energie pro svalové i jiné buňky, tedy dostatek glukózy. Zajišťují to katecholaminy, resp. adrenalin, který podporuje štěpení jaterního glykogenu, a glukokortikoidy (kortizol), které navíc stimulují glukoneogenezu. Každý nemocný v těžkém stavu je ve stresu; patří sem nemocní po operacích, úrazech, na jednotkách intenzivní péče, po infarktu myokardu či iktu, s těžkým zánětlivým onemocněním apod. Proto lze u všech těchto nemocných očekávat hyperglykémii. U těchto nemocných je třeba aktivně regulovat glykémii: měla by se pohybovat mezi 7–10 mmol/L; při nižší hodnotě hrozí hypoglykémie, vysoká hodnota zhoršuje přežití nemocných v kritickém stavu. Chceme-li u nich testovat glukózovou toleranci, je třeba počkat nejméně 6 týdnů po odeznění akutního stavu.
K dalším možným příčinám hyperglykémie patří:
- nadprodukce adrenalinu (feochromocytom, paragangliom) – adrenalin stimuluje štěpení jaterního glykogenu;
- nadprodukce glukokortikoidů (Cushingův syndrom) nebo dlouhodobá léčba vysokými dávkami glukokortikoidů – glukokortikoidy stimulují glukoneogenezi;
- nadprodukce dalších hormonů s antiinzulinovým účinkem (thyreoidální hormony, růstový hormon, prolaktin);
- onemocnění pankreatu s destrukcí Langerhansových ostrůvků (akutní či chronická pankreatitida, hemochromatóza, karcinom pankreatu);
- centrální hyperglykémie (traumata, edém či tumor mozku, encefalitida);
- stavy po gastrektomii (zrychlená pasáž glukózy do střeva a její zvýšená absorpce);
- vliv léků (glukokortikoidy přirozené i syntetické, thiazidová diuretika, některé fenothiaziny, perorální kontraceptiva, adrenalin, fenylhydantoin, kyselina nikotinová aj.).
14. Doporučená literatura
- American Association of Clinical Endocrinologists/American College of Endocrinology statement on the use of hemoglobin A1c for the diagnosis of diabetes. Endocrine Practice, 16(2), 2010:155-6
- Clin. Chem., 57, č. 2, 2011, většina čísla věnována problematice diabetes mellitus
- Cowie CC, Rust KF, Ford ES, Eberhardt MS, Byrd-Holt DD, Li C., Williams, et al. Full accounting of diabetes and pre-diabetes in the U.S. population of 1988-1994 and 2005-2006. Diabetes Care, 32(2), 2009: 287-94
- Davies MJ, D´Alessio DA, Fradkin J, Kernan WN, Mathieu C, Mingrone D, et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 41(12), 2018: 2669-701
- Diagnosis and classification of diabetes mellitus (American Diabetes Association). Diabetes Care, 32, 2009, Suppl. 1: S62-S67
- Gestační diabetes mellitus. Doporučený postup screeningu, gynekologické, perinatologické, diabetologické a neonatologické péče 2017. Dostupné z: https://www.diab.cz/dokumenty/DP_GDM_2017.pdf (diab.cz)
- Pelikánová T., Viklický O., Rychlík I., Saudek, F., Kvapil M., Tesař V., Zima T., Racek J., Bouček P. Doporučené postupy při diabetickém onemocnění ledvin. Dostupné z: https://www.cskb.cz/res/file/doporuceni/DM/dop_20170901_DKD.pdf
- Florkowski C. HbA1c as a diagnostic test for diabetes mellitus – reviewing the evidence. Clin Biochem Rev, 34(2), 2013: 75-83
- Friedecký B., Kratochvíla J., Springer D., Prázný M., Pelikánová T., Zima T., Racek J.: Diabetes mellitus – laboratorní diagnostika a sledování stavu pacientů. Společné doporučení České společnosti klinické biochemie ČLS JEP a České diabetologické společnosti ČLS JEP. Klin. Biochem. Metab., 27(1), 2019, 32-47.
- International expert committee report on the role of the A1C assay in the diagnosis of diabetes. Diabetes Care, 32(7), 2009: 1327-34
- Paneni F, Beckman JA, Creager MA, Consentino F. Diabetes and vascular disease: pathophysiology, clinical consequences, and medical therapy:part I. Eur Heart J, 34(31), 2013: 2436-43
- Perušičová J, Pelikánová T, Škrha J, Kvapil M, Šmahelová A. Doporučený postup péče o nemocné s prediabetem. Společné doporučení České diabetologické a České internistické společnosti ČLS JEP, 20. 1. 2012
- Škrha J. Aktuality v diagnostice diabetes mellitus. Postgrad Med, 13(4), 2011: 399