Kardiomarkery (učební text)
| Stránky: | POSTUDIUM |
| Kurz: | Kardiomarkery v klinické praxi |
| Kniha: | Kardiomarkery (učební text) |
| Vytiskl(a): | Nepřihlášený host |
| Datum: | neděle, 19. května 2024, 10.21 |
Popis
Verze textu vhodná i pro vytištění. Příslušné kapitoly jsou odkázány u jednotlivých témat.
Obsah
- 1. Akutní infarkt myokardu
- 1.1. Stanovení kardiálních troponinů
- 1.2. 99. percentil referenční populace
- 1.3. Časový průběh kardiálních troponinů při AIM a načasování náběrů
- 1.4. Rozlišení AIM dle etiologie
- 1.5. Poškození myokardu při dalších onemocněních
- 1.6. Kazuistika 1
- 1.7. Další laboratorní parametry zvýšené při AIM
- 1.8. Kazuistika 2
- 2. Srdeční selhání
- 3. Doporučená literatura
1. Akutní infarkt myokardu
Laboratorní vyšetření hrají významnou roli v diagnostice, nastavení léčby a prognóze nejčastějších kardiovaskulárních onemocnění – akutního infarktu myokardu (AIM) a srdečního selhání. V této kapitole se zaměříme na úlohu kardiálních troponinů a natriuretických peptidů.
AIM je relativně častý (13 % všech úmrtí) a život ohrožující stav způsobený ischemickou nekrózou myokardu. Příčinou ischémie je obvykle prasknutí aterosklerotického plátu a následné nasednutí krevní sraženiny. Nejdůležitějším laboratorním ukazatelem AIM v současnosti jsou kardiální troponiny (cTn). Tyto svalové bílkoviny se uvolňují téměř výhradně ze srdečního svalu a moderní metody jejich stanovení zachytí vzestup kardiálních troponinů několik hodin od začátku potíží – v době přijetí do nemocnice. Jde tedy o časný a velmi citlivý ukazatel poškození myokardu. Kromě AIM existují i další příčiny poškození myokardu, které rovněž vedou ke zvýšení kardiálních troponinů, např. poranění srdce, myokarditida či toxické poškození. K odlišení těchto příčin slouží především klinický obraz, EKG, zobrazovací vyšetření a částečně také dynamika naměřených hodnot kardiálních troponinů.
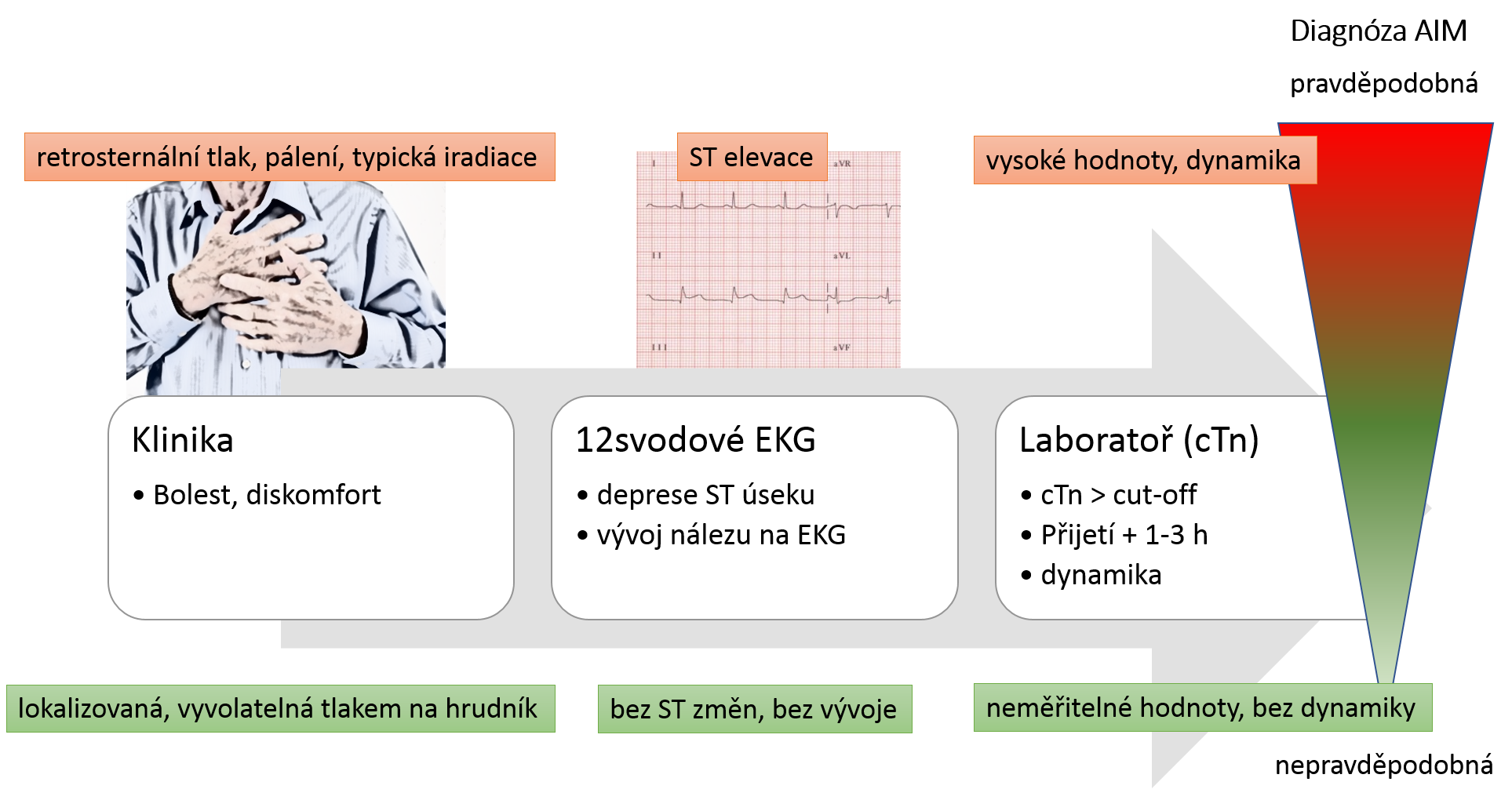
V diagnostice AIM kombinujeme informace ze 3 základních oblastí:
- klinický obraz – diskomfort (bolest, pálení, tlak) na hrudi, iradiace do dolní čelisti, do levé horní končetiny; gastrointestinální příznaky jako nauzea či zvracení; dušnost. Lokalizovatelná bolest nebo bolest vyvolatelná tlakem na hrudník pro AIM nesvědčí. Část pacientů je bezpříznakových.
- EKG a zobrazovací metody – 12svodové EKG by mělo být ideálně natočeno a interpretováno do 10 minut od kontaktu s pacientem. Např. nález typických ST elevací v minimálně 2 svodech vede k rychlé diagnóze akutního infarktu myokardu s ST elevacemi (STEMI) a k požadavku provést koronarografii do 120 minut. AIM bez ST elevací (NSTEMI) nemá specifický EKG obraz a při diagnostice jsou kardiální troponiny nepostradatelné. Ze zobrazovacích metod se rutinně používá echokardiografie, která poskytuje představu o struktuře srdce (např. síla stěn) i jeho funkci (např. porucha motility srdeční stěny odpovídající povodí koronární tepny). Magnetická rezonance srdce je schopná detekovat již nekrózu 1 g myokardu, rozliší ischemický a neischemický původ fibrózy. Rozšiřuje se i použití počítačové tomografie srdce (např. CT koronarografie).
- kardiální troponiny – jejich koncentrace v krvi překročí 99. percentil (viz dále) již při nekróze 40 mg myokardu. Kromě absolutní hodnoty si všímáme i dynamiky změn koncentrace, které nám pomohou odlišit chronické zvýšení kardiálních troponinů (např. chronické onemocnění ledvin nebo srdeční selhání) a akutní poškození myokardu (např. AIM)
Pravděpodobnost diagnózy AIM určují zejména klinické symptomy, EKG a koncentrace kardiálních troponinů.
Jako arbitrární mez, od které považujeme naměřené hodnoty kardiálních troponinů za známku poškození myokardu, byl určen 99. percentil referenční populace (viz následující obrázek). O akutní poškození myokardu se jedná, pokud zaznamenáme významný (> 20%) vzestup či pokles kardiálních troponinů.
Hodnotu 99. percentilu referenční populace bychom zjistili, kdybychom změřili koncentrace kardiálního troponinu u např. 100 lidí bez AIM, naměřené hodnoty bychom seřadili podle velikosti – 2. nejvyšší hodnota kardiálního troponinu by byla 99.

AIM je pak definován jako akutní poškození myokardu s alespoň jednou známkou ischémie myokardu – klinické příznaky ischémie myokardu (viz výše); nové EKG změny svědčící pro ischemii; známky nově vzniklé ztráty pohyblivosti nebo vitality myokardu zjištěné zobrazovací metodou; ev. nález intrakoronárního trombu během koronarografie či pitvy.
V následujícím textu podrobněji rozebereme patofyziologii kardiálních troponinů a vliv různých faktorů na jejich diagnostické vlastnosti.
Kardiální troponiny jsou bílkovinné součásti kontraktilního aparátu kosterního i srdečního svalu. Existují tři troponiny: T (nasedá na tropomyozin), I (inhibiční troponin) a C (váže Ca2+). Vlivem šíření akčního potenciálu dojde k otevření kanálů pro Ca2+ v sarkoplazmatickém retikulu, Ca2+ nasedne na troponin C a změnou konformace troponinového komplexu odhalí vazebná místa na aktinu pro myozin, která byla překryta troponinem I. Hlava myozinu se pak naváže na aktinové vlákno a dochází ke kontrakci svalu.
Troponiny T a I jsou v kosterním a srdečním svalu dostatečně odlišné a klinicky dostupnými analytickými metodami je můžeme spolehlivě odlišit, troponin C je v obou typech svalů obdobný. Pro diagnostiku AIM proto používáme kardiální troponin I nebo T. Specifita pro myokard je u troponinu I prakticky 100%, u troponinu T najdeme u některých svalových onemocnění (např. myopatie) jeho zvýšenou expresi i v kosterních svalech. Myopatie tak mohou být příčinou chronického zvýšení troponinu T.
1.1. Stanovení kardiálních troponinů
Pro stanovení troponinu T používáme elektrochemiluminiscenční imunoanalýzu (ECLIA), u troponinu I chemiluminiscenční imunoanalýzu (CLIA). Luminiscence je schopnost látek samovolně vydávat světlo; u chemiluminiscence je vyvolána chemickou reakcí, u elektrochemiluminiscence navíc průchodem elektrického proudu. CLIA i ECLIA patří k nejcitlivějším klinicky používaným imunoanalytickým metodám, které mohou stanovit i velmi nízké koncentrace analytu a jsou relativně málo náchylné k interferencím. Nicméně u ECLIA mohou vysoké dávky biotinu vést k falešně nízkým hodnotám troponinu T a významná hemolýza také falešně snižuje výsledek (snížení přibližně o 10 %). U troponinu I některých výrobců byly častěji popsány falešně vysoké hodnoty způsobené formováním makrokomplexů. Existuje i zkřížená reaktivita analytických protilátek mezi různými degradačními štěpy kardiálních troponinů. Musíme také zdůraznit, že přestože jsou diagnostické vlastnosti troponinu T a I u AIM srovnatelné, vydávané číselné hodnoty jsou odlišné. Jde o různé molekuly, s různými biologickými poločasy, s různými biologickými variabilitami – žádnou matematickou korekcí tedy nelze převádět koncentrace jednoho troponinu na druhý. Mezilaboratorní porovnatelnost u troponinu T je dobrá. U troponinu I jsou výsledky od různých výrobců bohužel nesrovnatelné a pro každou metodu je nutné používat různé rozhodovací meze.
Poslední generace analytických souprav pro kardiální troponiny jsou schopné stanovit velmi nízké koncentrace kardiálních troponinů a mají dobrou preciznost na 99. percentilu (variační koeficinet [CV] < 10 %). Označení „vysoce senzitivní“ („hypersenzitivní“, popř. „ultrasenzitivní“) se používá pro soupravy, které jsou schopny naměřit kardiální troponiny u minimálně 50 % zcela zdravých lidí. Nejcitlivější soupravy stanoví měřitelnou koncentraci kardiálního troponinu téměř u všech zdravých lidí. Zlepšená analytická citlivost tak umožňuje detekovat zvýšení kardiálních troponinů dříve a např. použití myoglobinu jako časného, ale nespecifického markeru AIM proto ztratilo význam. Ve velmi nízkých hodnotách (používaných např. pro vyloučení AIM) je nutné počítat s větší nejistotou výsledku.Klinicky použitelné jsou ještě metody na stanovení kardiálních troponinů s CV 10 až 20 %. Přestože jsou nabízeny i POCT metody na stanovení kardiálních troponinů, nebyl dosud prokázán pozitivní vliv na osud pacienta při jejich použití. Příčinou může být právě jejich vyšší nepreciznost a následně i neporovnatelnost s výsledky centrální laboratoře.
1.2. 99. percentil referenční populace
Výběr referenční populace a biologické variability hraje zásadní roli v určení a interpretaci 99. percentilu. Referenční populace by měla mít obdobnou charakteristiku jako populace pacientů vyšetřovaných pro podezření na AIM. Např. víme, že s věkem fyziologicky stoupá hladina kardiálních troponinů, muži mají vyšší hodnoty než ženy a velká fyzická námaha vede k vyplavení kardiálních troponinů i u zcela zdravých a trénovaných jedinců. Referenční populace by proto měla mít dostatečné zastoupení mužů a žen, všech relevantních věkových skupin a před odběrem krve je nutné se vyvarovat větší fyzické námahy. Pro každou skupinu (např. muži a ženy) by mělo být vyšetřeno minimálně 300 jedinců. Hodnota 99. percentilu klesá s dokonalostí vyšetření referenční populace – 99. percentil je vyšší u populace, u které zdraví definujeme na základě zběžného klinického vyšetření a dotazníku než u populace, kde vyšetříme i laboratorní parametry (např. odhad glomerulární filtrace nebo hladinu natriuretických peptidů) a zobrazovací metody (např. morfologii a funkci srdce při echokardiografii). Důvodem je, že při podrobnějším vyšetřování vždy odhalíme více jedinců s dosud nediagnostikovanou patologií. Kardiální troponiny patří mezi markery s relativně nízkou intraindividuální variabilitou (5 %) a vyšší interindividuální variabilitou (50 %), která dále významně stoupá u pacientů s komorbiditami (srdeční selhání, chronická ledvinná nedostatečnost). Kardiální troponiny proto patří mezi markery, kde použití referenčního rozmezí nebo jedné rozhodovací meze (99. percentilu) není optimální (Obrázek 13.2) a vhodnější je sledování vývoje hodnot v čase.
Při interpretaci hodnot zvýšených nad 99. percentil nesmíme tedy zapomenout, že:
- neexistuje jedna „univerzální“ referenční populace, různí výrobci a výzkumné skupiny používají různé referenční populace. Výsledkem jsou pak různé 99. percentily a rozdílné zařazení pacientů do skupin nad a pod 99. percentilem;
- velká interindividuální variabilita, zejména u pacientů se srdečním selháním a konečným stádiem ledvinné nedostatečnosti, podporuje preferenci sledování dynamiky hodnot kardiálních troponinů před porovnáním s 99. percentilem. RCV (viz kapitola Interpretace dat ) pro kardiální troponiny je přibližně 50 %. Arbitrárně stanovená změna (delta) o 20 % obsažená v univerzální definici AIM tak nemusí být zcela korektní. Doporučuje se větší změnu používat v nízkých hodnotách (pod 99. percentilem) a menší ve vyšších hodnotách. Stejnou logiku sleduje i použití absolutních hodnot pro delta (např. změna 5 ng/L v algoritmu na Obrázku 4) – v nižších hodnotách bude tato změna tvořit větší procento než ve vyšších.
Rozdílné 99. percentily pro muže a ženy mohou zlepšit diagnostické vlastnosti kardiálních troponinů, věkově specifické 99. percentily zatím klinické použití nenašly.
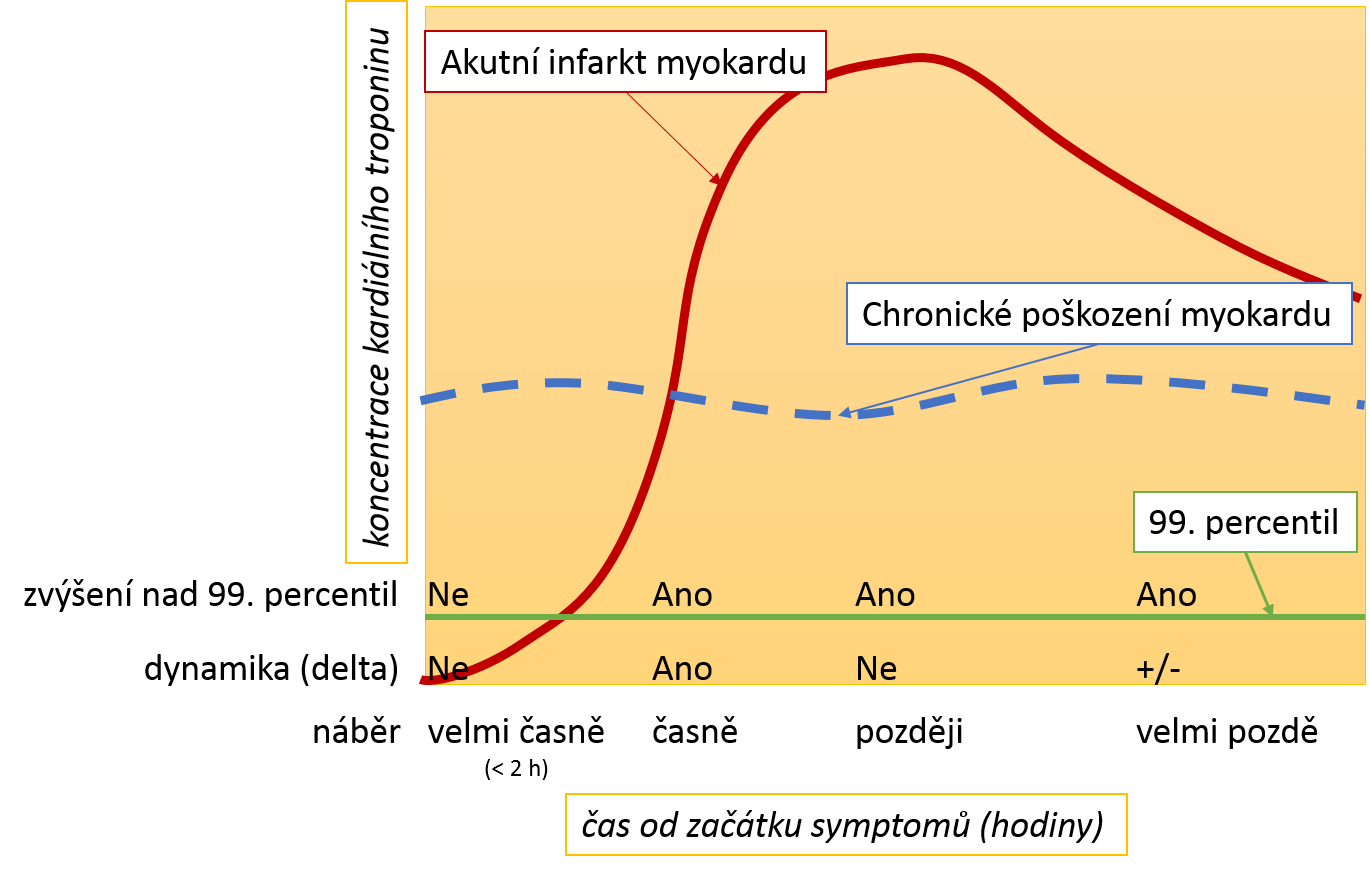
1.3. Časový průběh kardiálních troponinů při AIM a načasování náběrů
Vzestup kardiálních
troponinů je moderními analytickými metodami detekovatelný velmi časně od
začátku poškození myokardu. U AIM je vzestup velmi strmý, následuje fáze plató
a pozvolnější pokles. Rychlost poklesu je závislá zejména na
postupném uvolňování troponinů z nekrotického ložiska (na jeho velikosti a
prokrvení), a proto je uvádění obecného biologického poločasu poklesu
zavádějící. Z obrázku je patrné, že načasování náběrů vzhledem
k začátku symptomů je velmi důležité – optimální je náběry realizovat ve
strmě stoupající části křivky (časný náběr). Naopak v blízkosti vrcholové
koncentrace, ale i později během poklesu může být obtížné detekovat dostatečnou
dynamiku změn.
Porovnání časového průběhu koncentrací kardiálních troponinů u akutního a chronického poškození myokardu.
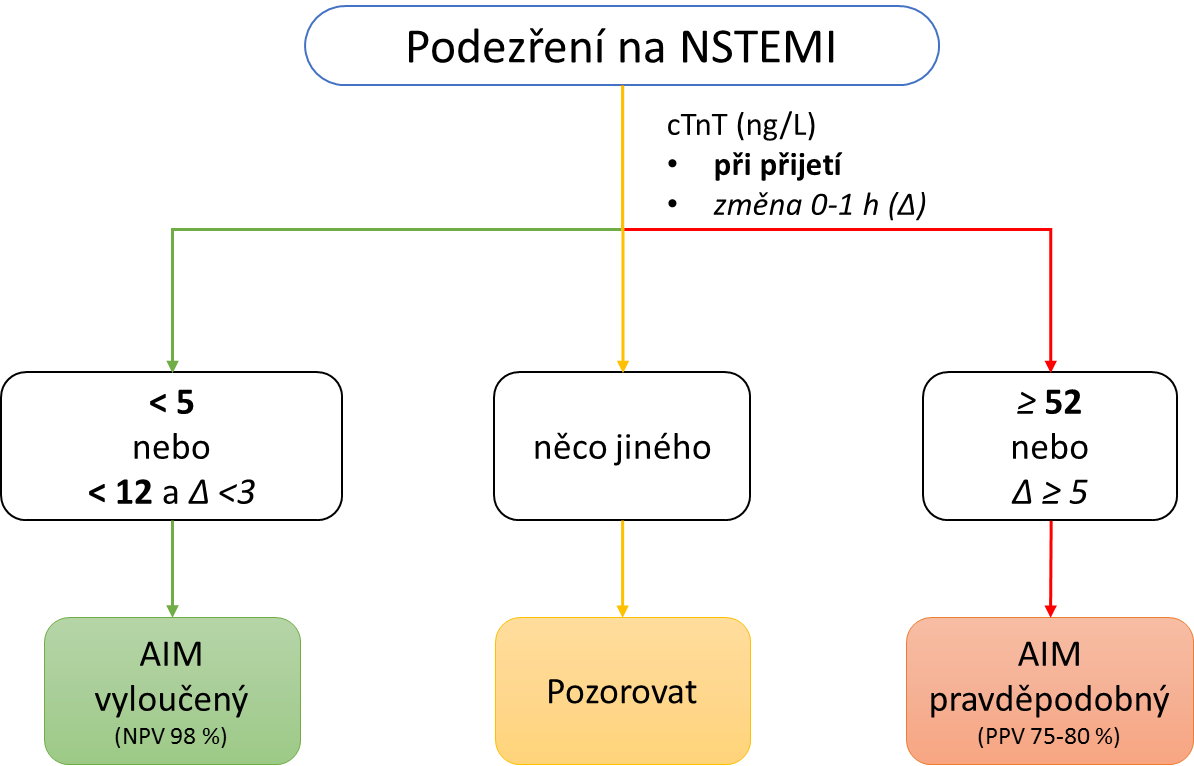
Z těchto předpokladů vycházejí časné diagnostické algoritmy pro AIM. Náběry se provádějí:
- při přijetí a
- za 1 hodinu
Alternativně místo náběru za 1 hodinu některé algoritmy používají náběr za 2 hodiny, jiné zas za 3 hodiny. Podmínkou použití těchto časných diagnostických algoritmů je měření kardiálních troponinů posledními generacemi analytických souprav – vysoce senzitivními metodami. Používáme 4 rozhodovací meze:
- vysokou a nízkou mez pro koncentraci kardiálního troponinu
- vysokou a nízkou mez pro změnu koncentrací kardiálního troponinu (tzv. delta) mezi prvním a druhým náběrem
Velmi nízká (neměřitelná) koncentrace nebo nízká koncentrace a velmi malá delta přítomnost AIM s velkou pravděpodobností vylučují (negativní prediktivní hodnota kolem 98 %). Vysoká hodnota kardiálního troponinu nebo vysoká delta významně zvyšují pravděpodobnost, že pacient má AIM, ale diagnostické vlastnosti jsou horší (pozitivní prediktivní hodnota je kolem 80 %). Příklad jednohodinového algoritmu s použitím rozhodovacích mezí pro kardiální troponin T ilustruje následující obrázek. Všimněte si, že sledování změny dynamiky koncentrací je přínosné zejména u hodnot kolem 99. percentilu a při lehce zvýšených hodnotách. U neměřitelných a velmi vysokých koncentrací se delta neuplatní. U pacientů, kteří se do nemocnice dostanou velmi brzy (do 2 h od začátku symptomů) nevylučuje nízká hodnota kardiálního troponinu spolehlivě AIM a je vhodné načasovat odběr s odstupem několika (1 až 3) hodin. Pacienti, kteří se dostanou do observační větve (nesplňují kritéria ani pro vyloučení AIM ani pro zařazení) mají vysoké riziko komplikací a úmrtí, proto je vhodné je hospitalizovat.
Příklad jednohodinového algoritmu při diagnostice AIM – uvedené hodnoty jsou pro kardiální troponin T měřený vysoce senzitivní metodou.
Podezření na reinfarkt, tedy AIM do 28 dnů po prvním infarktu, pojmeme při nových ischemických symptomech nebo EKG změnách (ST elevace, nové patologické Q). Kardiální troponin nabíráme při objevení se potíží a za 3 až 6 hodin, ev. dříve u vysoce senzitivních metod stanovení. Pokud je první hodnota cTn nízká, používáme stejná kritéria jako pro nový AIM. Je-li první hodnota vyšší než 99. percentil, požadujeme minimálně 20% vzestup cTn. Podmínkou je, aby první hodnota pocházela z období, kdy je koncentrace cTn stabilní nebo klesající.
1.4. Rozlišení AIM dle etiologie
AIM je většinou způsobený rupturou plátu a nasedající trombózou či krvácením do plátu, které způsobí uzávěr koronární tepny (AIM typ 1). Méně často je příčinou nepoměr mezi potřebou kyslíku a jeho dodávkou (AIM typ 2), přes klinické podezření a EKG známky AIM pacient zemře před stanovením koncentrace kardiálních troponinů (AIM typ 3) nebo jde o AIM způsobený komplikacemi při léčebných zákrocích: při koronarografii (AIM typ 4) či při aortokoronárním bypassu (AIM typ 5).
AIM typ 2 splňuje kritéria pro akutní ischemické poškození myokardu (klinické známky ischémie myokardu + kardiální troponin nad 99. percentil + významná dynamika změn troponinu). U AIM typu 1 jsou však potíže plynoucí z ischémie myokardu hlavním problémem. U AIM typu 2 většinou převažují další závažné problémy a komorbidity (Kazuistika 18.1), např. akcelerace hypertenze u pacienta s významnou hypertrofií myokardu, tachy- a bradyarytmie, krvácení a hypovolémie, selhání ventilace. Často se tyto příčiny vyskytují v terénu aterosklerózy koronárních tepen. Rozlišení obou typů je důležité, protože se liší strategie léčby: u AIM typu 1 primárně usilujeme o revaskularizaci uzavřené tepny, u AIM typu 2 se snažíme vyrovnat nerovnováhu v potřebě a dodávce kyslíku, např. úpravou srdeční frekvence, korekcí krevního tlaku, hypovolémie, podáním transfuzí nebo podporou ventilace.
AIM způsobený komplikacemi po koronarografii (typ 4) splňuje kritéria pro akutní poškození myokardu, objeví se do 48 hodin po proceduře a podobně jako u AIM typu 1 musí být přítomen alespoň jeden důkaz ischémie myokardu z následujících: nové ischemické změny na EKG, nové patologické vlny Q, obraz konzistentní s ischémií na zobrazovacích metodách, zobrazení komplikace během koronarografie (např. disekce koronární tepny). Vzestup kardiálního troponinu musí být:
- větší než pětinásobek 99. percentilu (u pacientů s normálními hodnotami cTn před koronarografií)
- vzestup minimálně o 20 % a zároveň dosáhnout minimálně hodnoty 5 x 99. percentil (u pacientů se zvýšenými hodnotami kardiálního troponinu před koronarografií, např. akutní revaskularizace při AIM).
V době před zákrokem musí být hodnoty kardiálního troponinu stabilní nebo klesat, jinak nelze diagnózu AIM typu 4 pomocí cTn stanovit. Pro diagnostiku je nutné nabrat kardiální troponiny před zákrokem a 3 až 6 hodin po něm. Typ 4a je spojený přímo s koronarografií, 4b je způsobený trombózou ve stentu a 4c restenózou ve stentu.
U AIM spojeného s aortokoronárním bypassem (typ 5) jsou úvahy obdobné jako u typu 4, jen kritérium pro vzestup cTn je vyšší: minimálně 10 x 99. percentil; často jsou hodnoty mnohem vyšší.
U 6-8 % pacientů s AIM neprokážeme uzávěr koronární arterie ani nenajdeme příčinu jinde (typ 2, periprocedurální AIM, ...). Příčinou AIM pak může být spasmus koronárních tepen nebo v době koronarografie již spontánně rekanalizovaný uzávěr. Tento typ AIM nacházíme častěji u žen a používá se pro něj zkratka MINOCA (Myocardial Infarction with Non-Obstructive Coronary).
1.5. Poškození myokardu při dalších onemocněních
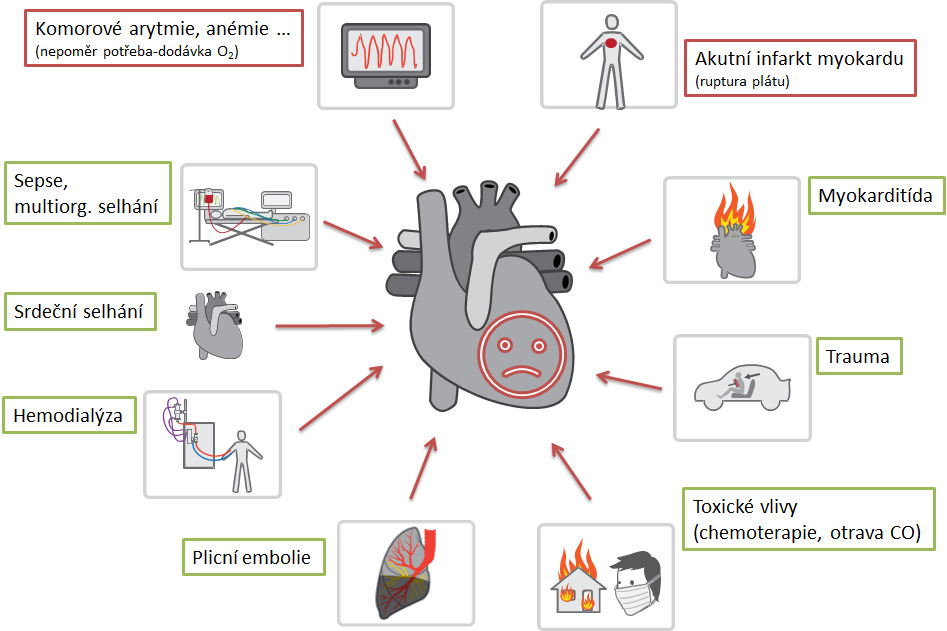
Poškození myokardu prokázané jako vzestup cTn nad 99. percentil najdeme nejen u AIM, ale i u celé řady jiných onemocnění (Kazuistika 1). Zejména často najdeme zvýšené hodnoty cTn u pacientů (viz také obrázek):
- se srdečním selháním – obvykle jde o chronické poškození, ale např. při akutním dekompenzovaném srdečním selhání může být jeho příčinou AIM. Pacienti pak mívají ischemické symptomy, změny na EKG a dynamika změn cTn prokazuje akutní poškození.
- s chronickým onemocněním ledvin – příčinou zvýšení cTn je zejména chronické poškození myokardu, méně pokles glomerulární filtrace. Kritéria pro diagnózu AIM jsou u těchto pacientů stejná, jen vzhledem k chronickému zvýšení cTn dáváme větší důraz na dynamiku jeho změn. Nicméně i významná dynamika cTn může být způsobena akutním objemovým přetížením i srdečním selháním a diagnostika AIM musí proto být vždy komplexní (klinické známky, EKG, zobrazovací vyšetření).
- kriticky nemocných – zvýšení cTn v akutních stavech (např. sepse, hypovolemický šok) je často způsobeno nepoměrem mezi potřebou O2 a jeho dodávkou myokardu (AIM 2. typu) ev. i kombinací s uzávěrem koronární tepny. Léčebnou prioritou je zde samozřejmě akutní stav.
- s Tako-Tsubo syndromem – někdy označovaný jako „syndrom zlomeného srdce“, obvykle vzniká na podkladě silného emočního stresu (např. úmrtí blízké osoby), častěji nacházíme u žen středního věku. V patofyziologii se pravděpodobně uplatňuje vliv katecholaminů (vazokonstrikce, zvýšení metabolismu). Klinickým obrazem imituje STEMI. Na EKG jsou patrné ST elevace ve svodech zahrnujících více koronárních tepen. Koncentrace kardiálních troponinů většinou dosahuje nižších hodnot než u STEMI a elevace bývá patrná po kratší dobu. Relativně typický je obraz na echokardiografii a koronarografie je bez známek uzávěru koronární tepny, i když koincidence se závažnou koronární aterosklerózou není vzácná.
Některé příčiny zvýšení
kardiálních troponinů. Z příčin AIM jsou zmíněny ruptura plátu s nasedajícím
trombem a uzávěrem koronární tepny nebo nepoměr mezi potřebou 02 a jeho
dodávkou. Ostatní příčiny jsou “neinfarktové”. Je vhodné zdůraznit, že v každém
případě je zdrojem kardiálních troponinů srdeční sval.
1.6. Kazuistika 1
76letá žena přichází pro náhle vzniklou dušnost. V anamnéze je léčená arteriální hypertenze a léčba karcinomu prsu ablací, ozářením a chemoterapií před 6 lety. Na EGK je sinusový rytmus s frekvencí 100/min a ST elevace 1 mm ve V1-3. Poslechově na plicích spastické fenomény a nečetné drobné chrůpky při bazích. Rentgen srdce a plic s projevy kardiálního selhávání.
Z laboratorních výsledků:
|
Analyt |
Výsledek při přijetí |
Výsledek za 1 hodinu |
Referenční rozmezí (RR) |
Porovnání s RR |
|
S-bilirubin |
6 |
|
< 25 µmol/L |
- - - - | * | - - - - |
|
B-Hemoglobin |
136 |
|
120 – 160 g/L |
- - - - | * | - - - - |
|
S-AST |
0,82 |
|
< 0,6 µmol/L |
- - - - | - | * - - - |
|
S-ALT |
0,57 |
|
< 0,7 µmol/L |
- - - - | * | - - - - |
|
S-CK |
5,11 |
|
< 2,4 µmol/L |
- - - - | - | - * - - |
|
S-myoglobin |
388 |
|
25 – 57 µg/L |
- - - - | - | - * - - |
|
S-cholesterol |
6,83 |
|
< 5 mmol/L |
- - - - | - | - * - - |
|
S-LDL cholesterol |
4,58 |
|
< 3 mmolo/L |
- - - - | - | - - * - |
|
S-kreatinin |
111 |
|
44 – 80 µmol/L |
- - - - | - | * - - - |
|
eGFR (CKD-EPIkrea) |
0,69 |
|
> 1 ml/s |
- - * - | - | - - - - |
|
S-CRP |
5 |
10 |
< 8 mg/L |
- - - - | * | - - - - > |
|
S-cTnT |
820 |
1208 |
< 14 ng/L |
- - - - | - | - * - - >> |
|
S-NT-proBNP |
3144 |
|
< 125 ng/L |
- - - - | - | - - -*- |
|
B-pH |
7,16 |
|
7,36 – 7,44 |
- - * - | - | - - - - |
|
B-pCO2 |
8,8 |
|
4,8 – 5,8 kPa |
- - - - | - | - * - - |
|
B-HCO3- |
24,2 |
|
22 – 26 mmol/L |
- - - - | * | - - - - |
|
B-BE |
-4,8 |
|
-2 – 2 mmol/L |
* - - * | - | - - - - |
|
B-pO2 (O2 ve vdechovaném vzduchu 30 %) |
3,5 |
|
6,5 – 11,5 kPa |
* - - | - | - - - - |
|
B-laktát |
3,9 |
|
< 2,2 mmol/L |
- - - - | - | - * - - |
|
S-glukóza |
18,4 |
|
2,6 – 5,6 mmol/L |
- - - - | - | - * - - |
|
S-Na |
144 |
|
137 – 145 mmol/L |
- - - - | * | - - - - |
|
S-K |
6,0 |
|
3,6 – 4,8 mmol/L |
- - - - | - | - * - - |
|
S-Cl |
114 |
|
98 – 109 mmol/L |
- - - - | - | * - - - |
|
S-osmolalita |
307 |
|
275 - 295 |
- - - - | - | - * - - |
|
S-albumin |
46,4 |
|
35 – 50 g/L |
- - - - | * | - - - - |
Komentář:
Klinický obraz, EKG i dynamika kardiálních troponinů podporují diagnózu akutního infarktu myokardu. Echokardiografie s EFLK 30 % a s obrazem vyklenování celé stěny levé komory srdeční v systole a zaškrcením při bazi však neodpovídá povodí jedné koronární tepny. Na koronarografii pouze nález drobných nerovností, bez průkazu uzávěru koronární tepny. O AIM tedy nejde, i když rizikové faktory aterosklerózy by tuto diagnózu podporovaly. Etiologie dušnosti je selhávání levé komory srdeční – kromě nálezu na echokardiografii to podporuje i vysoká hladina NT-proBNP. Pro ev. plicní zánět nesvědčí RTG obraz a nízká hodnota CRP. Lépe by v rozhodování o ev. nasazení antibiotik pomohlo měření prokalcitoninu, které však nebylo indikováno. Vyšetření acidobazické rovnováhy a krevních plynů prokazuje akutní (nekompenzovanou) respirační acidózu kombinovanou s hypoxickou laktátovou acidózou. Pravděpodobnou příčinou je srdeční selhání s otokem plic a špatnou výměnou plynů a následná hypoxie tkání a zvýšená tvorba laktátu. Kontrolní echokardiografie s týdenním odstupem prokazuje normální funkci a morfologii všech srdečních oddílů. Až takto rychlá normalizace srdečních funkcí potvrdila podezření na Tako-Tsubo syndrom, koincidenci s AIM 2. typu nelze vyloučit.
Z dalších příčin elevace cTn jmenujme myokarditidu, trauma – nejčastěji nárazem hrudníku na volant, kardiotoxické léky – zejména protinádorové (např. antracykliny – doxorubicin, herceptin), otrava oxidem uhelnatým, plicní embolie, disekce aorty, popáleniny nad 30 % tělesného povrchu, hypotyreóza. Tyto případy často splňují podmínky akutního poškození myokardu. Zásadní roli při odlišení od AIM hraje anamnéza, klinický obraz, EKG a zobrazovací metody.
1.7. Další laboratorní parametry zvýšené při AIM
Mezi laboratorní ukazatele, které jsou v krvi při AIM zvýšené, ale již nemají v jeho diagnostice svoje místo, patří: aktivita kreatinkinázy (CK), aktivita MB izoenzymu CK (CK-MB), aktivita laktátdehydrogenázy (LD), aktivita aspartátaminotransferázy (AST) a hladina sérového myoglobinu. Univerzální definice z roku 2018 ještě zmiňuje CK-MB mass (CK-MB stanovené imunochemickou metodou) jako alternativu kardiálních troponinů, pokud ty nejsou k dispozici. Vzhledem ke shodnému přístrojovému vybavení pro stanovení troponinů a CK-MB mass takový případ prakticky nenastává. AST a LD zde rozebírat nebudeme, na tomto místě krátce představíme kreatinkinázu a myoglobin.
Kreatinkináza (82 kDa) je převážně cytoplazmatický enzym, který může obsahovat 2 podjednotky M a B. Jejich kombinací vznikají následující izoenzymy: CK-BB (hlavně v mozku), CK-MM (hlavně v kosterním svalu), CK-MB (hlavně v srdci, ale i v kosterním svalu je asi 5 % MB a stoupá při jeho regeneraci; naopak srdce má asi 60 % MM izoenzymu). Ženy mají fyziologicky nižší hodnoty aktivity CK v séru než muži. Jde o nejlepší marker svalového poškození: v krvi stoupá téměř ihned po poškození svalů, maxima dosahuje za 1-2 dny, poločas vymizení z plazmy je asi 22 hodin. Je tedy vhodný i pro monitorování průběhu poškození svalů a reakce na léčbu. Zvýšení můžeme charakterizovat jako: mírné – 2 až 5x nad horní referenční mez (HRM); střední – 5 až 10x nad HRM; značné – více než 10x nad HRM. Není-li svalová zátěž extrémní, tak nestoupá více než 4x. K významnému rozpadu svalové tkáně, k rabdomyolýze, dochází např. při náročném cvičení nebo křečích; po traumatu; působením toxických látek, léků a drog (alkohol, kokain, amfetaminy, metamfetaminy, kortikosteroidy, statiny); při hypotyreóze; myozitidách; hypokalémii, hyponatrémii nebo při svalových dystrofiích. Při všech těchto stavech najdeme i zvýšení CK v krvi. Vzestup CK v krvi je rychlejší při poranění svalů a křečích, pomalejší u toxických a metabolických příčin. Z rozmístění CK v různých orgánech je zřejmé, že ke zvýšení může dojít i při nemocech CNS (např. iktus, bakteriální meningitida, úraz hlavy) a při onemocněních srdce.
Myoglobin je svalový protein o velikosti pouhých 18 kDa – jde tedy o mikroprotein, který volně proniká glomerulárním sítem a v proximálním tubulu je zpětně resorbován. Při významném poklesu GF se proto jeho koncentrace zvyšuje i bez poškození svalů. Molekula myoglobinu obsahuje hem – je schopná vázat kyslík a následně jej poskytovat pro oxidativní metabolismus svalů. Myoglobin z kosterních svalů i z myokardu je identický, nelze jej laboratorními metodami rozlišit. Při rabdomyolýze přesahuje uvolněné množství myoglobinu resorpční kapacitu tubulů a myoglobin nacházíme i v definitivní moči. Tento typ proteinurie nazýváme prerenální nebo „overflow“ a přítomnost myoglobinu v moči způsobí falešně pozitivní výsledek krve v moči (viz kapitola Ledviny ). Precipitace myoglobinu v tubulech, zejména při sníženém pH moče, velmi vysoké koncentraci myoglobinu při závažné rabdomyolýze a hypovolémii či krvácení, může způsobit akutní poškození a následně selhání ledvin. Prevencí akutního poškození ledvin (AKI) při rabdomyolýze je zejména doplnění cirkulujícího objemu krve; při selhání ledvin je někdy nezbytná hemodialýza.
Při podezření na rabdomyolýzu je vhodné v plazmě kromě hladiny myoglobinu vyšetřit: CK, ureu, kreatinin, Na+, K+, Cl-, Mg2+, Ca2+ a nezapomenout na hladinu etanolu v krvi a screening drog. Je nutné počítat s rizikem významné hyperkalémie pro možné selhání ledvin a vyplavení K+ ze svalových buněk.
1.8. Kazuistika 2
20letý netrénovaný muž se vsadil, že udělá naráz 600 dřepů. Udělal jich 300 a pro svalovou únavu dál nepokračoval. Druhý den cítil značnou bolest ve stehenních svalech a pozoroval červenou moč. Byl vyšetřen na urologické ambulanci FN v Plzni, kde bylo provedeno laboratorní vyšetření a sonografie ledvin
Z laboratorních výsledků při přijetí:
|
Analyt |
Výsledek |
Referenční rozmezí (RR) |
Porovnání s RR |
|
S-AST |
42,7 |
< 0,8 µkat/L |
- - - - | - | - - - * |
|
S-ALT |
7,44 |
<1,0 µkat/L |
- - - - | - | - * - - |
|
|
|
|
|
|
Krev v moči chemicky |
3 |
0 arb. j |
- - - - | - | - - * - |
|
Erytrocyty v moči |
20 |
< 15/µL |
- - - - | - | * - - - |
Komentář:
Stav zhodnocen urologem jako ponámahová hematurie. Na základě diskrepance AST/ALT bez zvýšení bilirubinu doplněno klinickým biochemikem stanovení CK a myoglobinu – obě hodnoty byly extrémně vysoké CK > 600 µkat/L (RR < 3,2 µkat/L), myoglobin > 8 000 µg/L (RR 28 – 72 µg/L). Myoglobinurii odpovídá i nepoměr krev a erytrocytů v moči. V tomto případě se nejedná o hematurii, ale myoglobinurii (myoglobin reaguje pseudoperoxidázovou reakcí), myoglobin jako bílkovina rovněž mírně zvyšuje bílkovinu v moči. Aminotransferázy budou s velkou pravděpodobností jen svalového původu, nemusí jít (a nejspíš ani nejde) o postižení jater, ALT je rovněž ve svalech, ale v malém množství (asi 10x méně než AST). Vzhledem k obrovským hodnotám CK a myoglobinu bylo doporučeno kontaktovat nefrologa. Funkce ledvin však během pětidenní hospitalizace nebyla alterovaná. Při hydratační terapii došlo k postupnému poklesu ukazatelů rabdomyolýzy a normalizaci močového nálezu.
2. Srdeční selhání
Srdeční selhání (SS) je každoročně příčinou úmrtí více než 25 miliónů lidí na celém světě. S rostoucím věkem incidence stoupá. U lidí nad 65 let je akutní srdeční selhání nejčastější příčinou hospitalizace.
Diagnóza SS je založena na kombinaci symptomů pacienta, známkách při fyzikálním vyšetření a průkazu změn v myokardu pomocí zobrazovacích metod a natriuretických peptidů. Mezi typické symptomy řadíme dušnost, otoky kotníků či sníženou toleranci zátěže a únavu. Při fyzikálním vyšetření můžeme odhalit zvýšenou náplň krčních žil, chrůpky na plicích nebo zmíněné otoky končetin. Základní dělení SS vychází z ejekční frakce levé komory (EFLK) – je-li normální (≥ 50 %), mluvíme o SS se zachovalou ejekční frakcí levé komory; je-li EFLK mezi 40 a 49 %, mluvíme o SS s EFLK ve středním pásmu; EFLK < 40 % určuje SS s redukovanou EF. U SS se zachovalou EFLK a s EFLK ve středním pásmu je pro diagnostiku nezbytné zvýšení natriuretických peptidů (NP, viz níže) nad 35 ng/L u BNP a nad 125 ng/L u NT-proBNP. Zároveň musí být přítomna alespoň jedna známka strukturálních či funkčních změn v srdci: hypertrofie levé komory či rozšíření levé síně nebo diastolická dysfunkce.
Etiologicky je SS způsobeno nejčastěji poškozením myokardu (např. AIM, kardiotoxické látky, infekční či imunitní poškození), jeho nadměrnou zátěží (např. hypertenze, chlopenní vady, sepse) nebo srdeční arytmií (tachy- a bradyarytmie). Z hlediska strategie léčby je důležité rozlišit chronické SS – postupný rozvoj a zhoršování obtíží; od SS s akutním začátkem – může nasedat na chronické SS, ale má náhlou příčinu zhoršení stavu nebo nově vzniklého SS (např. po AIM).
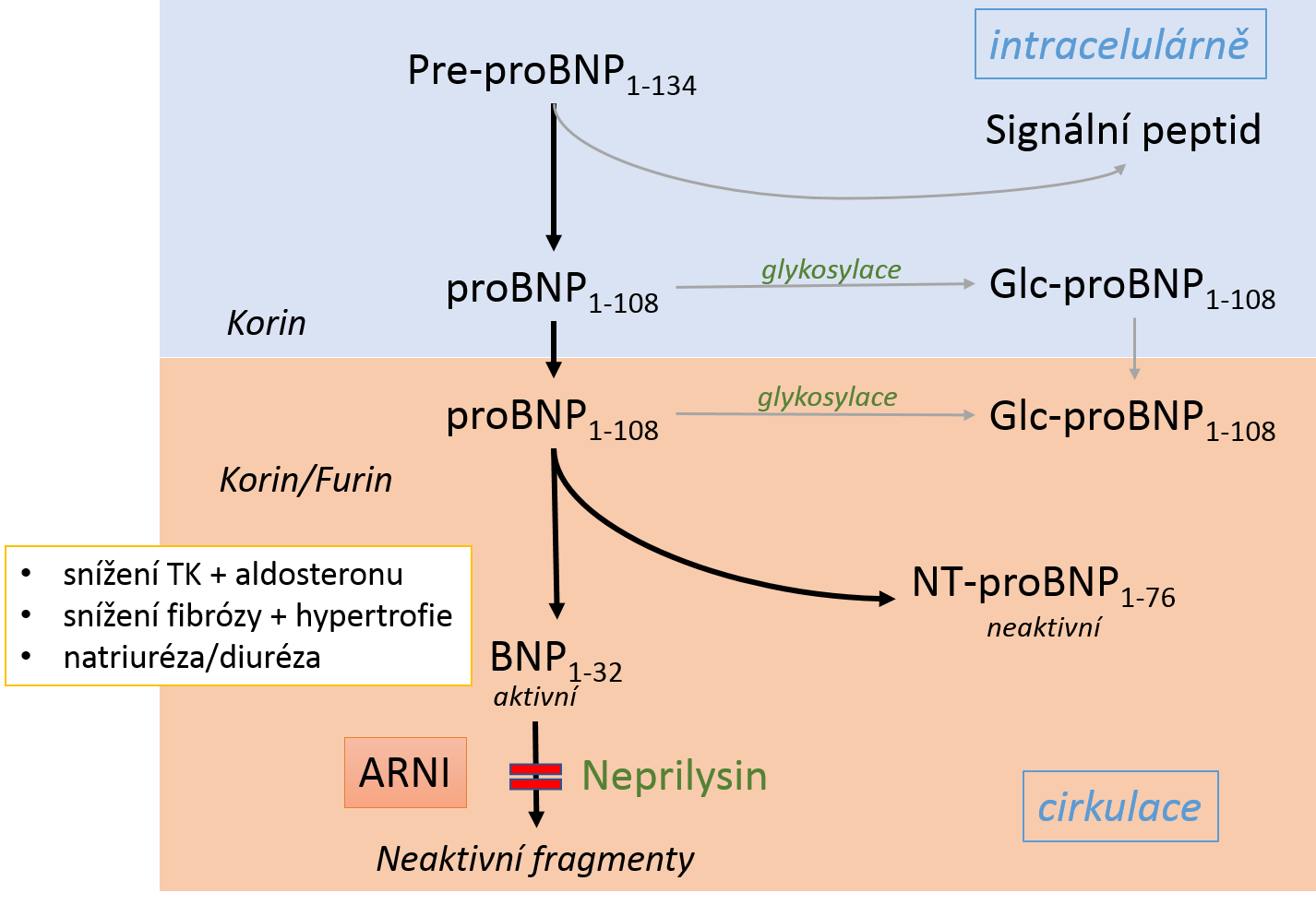
Natriuretické peptidy (NP) jsou molekuly charakteru hormonu, které se uvolňují při roztažení srdečních komor. Kromě patofyziologické úlohy v metabolismu sodíku (viz kapitola Ionty ) a remodelace myokardu pomáhá jejich zvýšená hodnota při diferenciální diagnostice dušnosti. Klinicky se nejvíce využívá stanovení mozkového natriuretického peptidu (brain natriuretic peptide, BNP) a jeho prekurzoru N-terminálního fragmentu proBNP (NT-proBNP). Základní metabolismus NP shrnuje Obrázek níže. Vzhledem k větší velikosti a absenci receptorů jsou NT-proBNP a proBNP vylučovány především ledvinami, zatímco BNP je odbouráván kombinací receptorů, endopeptidáz, proteolytických enzymů a glomerulární filtrace.
Stanovení NP provádíme v klinické praxi pomocí imunoanalytických metod – BNP s CLIA a NT-proBNP s ECLIA (principy těchto metod jsou uvedeny výše). Problémem stanovení NP je významná zkřížená reaktivita s proBNP a částečně i s degradačními štěpy BNP. Mezilaboratorní porovnatelnost výsledků je pro NT-proBNP i BNP špatná, zejména při stanovení soupravami od různých výrobců. Nepreciznost mezi výsledky jednotlivých výrobců přesahuje 40 % a bias i více než 45 %. Prozatím experimentálně se používá stanovení pomocí hmotnostní spektrometrie. Porovnání výsledků imunoanalytických metod s výsledky získanými hmotnostní spektrometrií ukazují, že většinu imunoreaktivních NP stanovovaných imunoanalytickými metodami tvoří proBNP a korelace mezi výsledky obou principů metod je chabá. Dalším experimentálním přístupem k zjištění koncentrace biologicky aktivních natriuretických peptidů jsou eseje založené na aktivaci cGMP přes receptor pro natriuretické peptidy A (NPR-A). Někdy se BNP podává léčebně, zvýšenou hladinu BNP způsobí i podávání inhibitorů neprilysinu. Hladina BNP je pak spíše známkou účinku léčby než odrazem tíže srdečního selhání. Stanovení NT-proBNP není těmito léky ovlivněno. Stabilita BNP při pokojové teplotě je nízká, vzorek by měl být analyzován do 4 hodin od odběru; NT-proBNP je stabilní. Přibližná kritická diference (RCV) pro NP je kolem 50 % – mluvíme-li o poklesu či vzestupu, měl by proto být vždy větší než 50 %.
Zjednodušený metabolismus BNP. Z peptidového prekurzoru se odštěpením signálního peptidu stává proBNP, který štěpením korinem nebo furinem dává vznik aktivnímu natriuretickému peptidu BNP (4 kDa) a neaktivnímu peptidu NT-proBNP (8 kDa). BNP je pak rozkládán na převážně neaktivní fragmenty různými enzymy, např. neprilysinem. Biologický poločas BNP je přibližně 20 minut, NT-proBNP 1 až 2 hodiny. Čísla v dolním indexu naznačují délku aminokyselinového řetězce peptidu, ARNI – duální inhibitory angiotenzinového receptoru a neprilyzinu.
Změření hladiny NP významně pomáhá v diferenciální diagnostice při podezření na srdeční selhání (Obrázek níže). Koncentrace natriuretických peptidů stoupá s rostoucím věkem, s poklesem glomerulární filtrace, u žen a při anémii. Naopak u obézních pacientů pozorujeme nižší hodnoty NP. Podobně jako u kardiálních troponinů mají velmi nízké hodnoty NP vysokou negativní prediktivní hodnotu – kolem 95 % při cut-off hodnotách pro BNP a NT-proBNP 35 a 125 ng/L u chronického a 100 a 300 ng/L u akutního srdečního selhání. Nízké hodnoty NP tedy srdeční selhání poměrně spolehlivě vylučují. Ale pozitivní prediktivní hodnoty jsou na těchto rozhodovacích mezích nízké – kolem 50 %. Proto je vhodné používat vyšší cut-off hodnoty pro potvrzení diagnózy, ideálně členěné dle věku:
- v diagnostice chronického srdečního selhání (neakutní začátek potíží):
- diagnóza nepravděpodobná, když NT-proBNP < 125 ng/l; negativní prediktivní hodnota se mění s věkem, proto jsou doporučovány tyto cut-off hodnoty dle věku:
- < 50 let 50 ng/l
- 50 až 75 let 75 ng/l
- >75 let 250 ng/L
- diagnóza pravděpodobná, pokud NT-proBNP > 1000 (až 2000) ng/l -> zde je konfirmační úloha NT-proBNP lehce nejasná
- diagnóza nepravděpodobná, když NT-proBNP < 125 ng/l; negativní prediktivní hodnota se mění s věkem, proto jsou doporučovány tyto cut-off hodnoty dle věku:
- diagnostice akutního srdečního selhání (akutní začátek potíží):
- diagnóza nepravděpodobná, když NT-proBNP < 300 ng/l
- diagnóza potvrzena, pokud NT-proBNP > 900 ng/l; nicméně pozitivní prediktivní hodnota se mění s věkem a s cut-offy nastavenými dle věku dosáhneme lepších diagnostických vlastností:
- < 50 let 450 ng/l
- 50 až 75 let 900 ng/l
- >75 let 1 800 ng/L
U pacientů s chronickým onemocněním ledvin (CKD) a zejména u pacientů na chronické hemodialýze jsou NP obvykle chronicky zvýšené a cut-off hodnoty je nutné přizpůsobit. Např. u pacienta mladšího 50 let s CKD by rozhodovací mez u akutního začátku byla pro NT-proBNP 1200 ng/L a nad 50 let již 4500 ng/L. Použití natriuretických peptidů v dětské populaci není doposud ustáleno, ale je zřejmé, že referenční rozmezí je u novorozenců významně vyšší (vrcholí v prvním dnu po narození a dosahuje až hodnot 1 500 pmol/L, do 3 dne po narození se dostává na hodnoty kolem 500 pmol/L); lehce vyšší hodnoty najdeme až do 18 let věku, kdy se přiblíží dospělým hodnotám. Jsou navrženy specifické cut-off hodnoty pro specifické patologie (defekt septa, transplantace srdce …).
Kromě anamnézy, fyzikálního vyšetření a hladiny NP je nezbytnou součástí vyšetření pacienta i EKG – normální EKG výrazně snižuje pravděpodobnost SS. Ze zobrazovacích vyšetření je nejrozšířenější echokardiografie, která neinvazivně odhalí významné morfologické i funkční odchylky. Rutinní součásti evaluace pacienta s podezřením na SS bývá i rentgen srdce a plic – odhalí městnání v plicích a plicní onemocnění. Při pátrání po etiologii SS může být přínosné vyšetření MR (např. myokarditida, střádavé choroby).
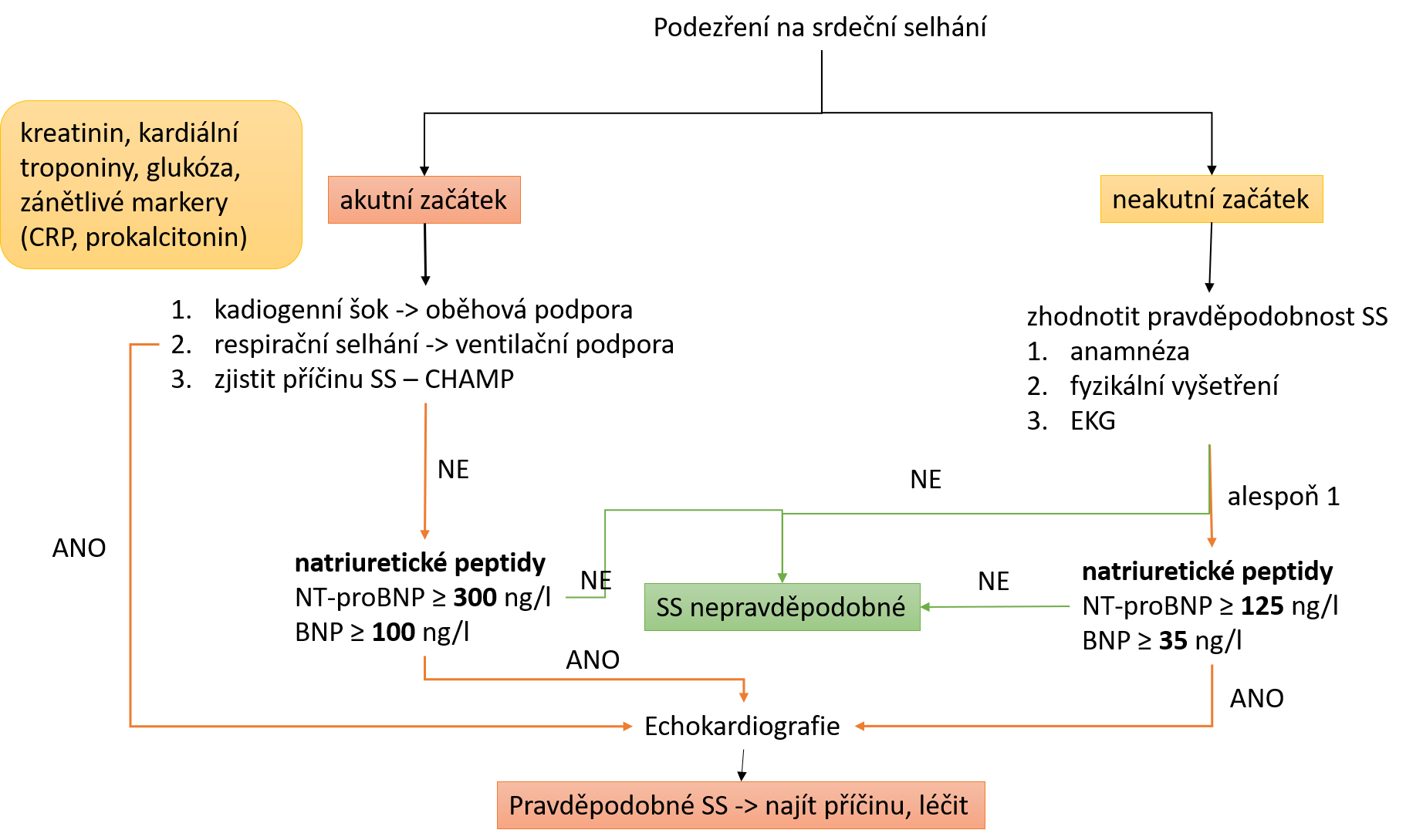
Diagnostický algoritmus
při podezření na srdeční selhání. Při akutním začátku je prioritou stabilizace
životních funkcí. U akutního začátku i chronického SS je však cílem najít příčinu
a léčit podle ní. Všimněte si i vybraných laboratorních parametrů, které by při
vyšetření pacienta s podezřením na SS neměly chybět (žlutý rámeček, podrobněji
v textu). CHAMP – akutní koronární syndrom (C), hypertenze (H), arytmie (A),
mechanická příčina – ruptura myokardu, akutní mitrální regurgitace po AIM …(M),
plicní embolizace (P).
Kromě zásadní úlohy v diferenciální diagnostice dušnosti se ukazuje, že NP jsou i významným prognostickým faktorem přežití u pacientů se SS. Spolu s kardiálními troponiny jejich hladina dobře koreluje s morbiditou a mortalitou. Zdá se, že největší vypovídací hodnotu má koncentrace NP před propuštěním z nemocnice.
Další laboratorní metody nám mohou pomoci odhalit příčinu SS či komorbidit:
- anémie – hemoglobin a metabolismus železa (feritin, transferin, železo)
- infekce a zánět – leukocyty, CRP a prokalcitonin, kombinace SS s pneumonií je častá
- poruchy štítné žlázy – TSH
- iontové dysbalance – zejména hypo- a hyperkalémie, hyponatrémie
- onemocnění ledvin – urea, kreatinin a z něj odvozený odhad GF
- rizikové faktory aterosklerózy – lipidový profil, glukóza a glykovaný hemoglobin
- známky postižení jater – bilirubin, ALT, GGT.
Prevence rozvoje SS u rizikových pacientů je efektivním způsobem, jak předcházet symptomatickým a těžkým formám SS. Prevence je založena na včasné léčbě známých rizikových faktorů – hypertenze, dyslipidémie, diabetu mellitu, obezity, odvykání kouření a omezení spotřeby alkoholických nápojů. Vhodná je i farmakoterapie (ACEI + beta-blokátory, viz dále) asymptomatických nemocných s prokázanou systolickou dysfunkcí. U pacientů s hypertenzí, diabetem mellitem nebo s kardiovaskulárním onemocněním může hladina NP (např. na cut-off hodnotě 50 ng/L pro BNP) efektivně identifikovat pacienty, u kterých je vhodná péče specialisty. Podobně u pacientů léčených kardiotoxickými léky (např. protinádorové léky – antracykliny, herceptin) mohou zvýšené hladiny kardiálních troponinů nebo natriuretických peptidů odfiltrovat pacienty s vysokým rizikem oddáleného rozvoje srdečního selhání a léčbu zahájit již v bezpříznakovém stádiu.
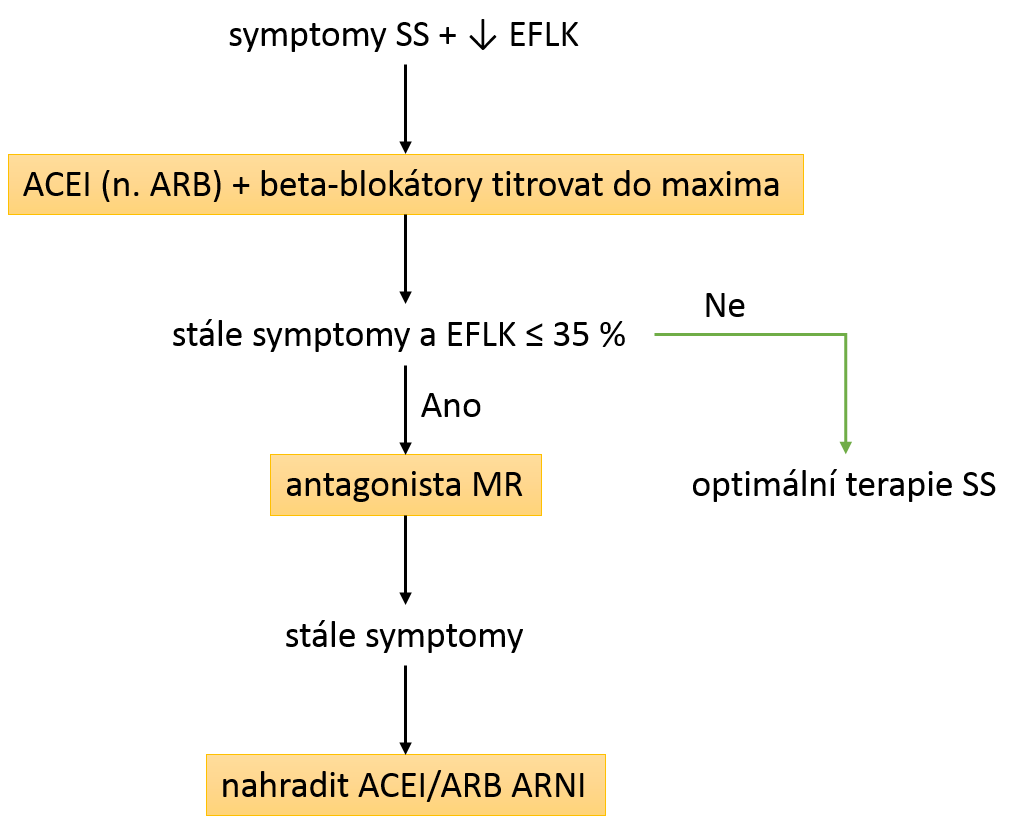
Při léčbě SS používáme především farmakoterapii (viz následující obrázek), ev. intervenční metody jako koronarografii či resynchronizační terapii. Diuretika, hlavně furosemid a thiazidy, používáme k symptomatické úlevě. Kombinace ACEI/ARB a antagonisty mineralokortikoidních receptorů může vést, zejména při současném poklesu GF, k život ohrožující hyperkalémii. Proto je nutné mít údaj o eGFR a po nasazení těchto léků monitorovat kalium v krvi.
Základní farmakoterapie
srdečního selhání. ACEI – inhibitory angiotenzin konvertujícího enzymu; ARB –
blokátory angiotenzinových receptorů; antagnista MR – antagonista
mineralokortikoidních receptorů (např. spironolakton); ARNI – duální inhibitory
angiotenzinového receptoru a neprilyzinu.
Natriuretické peptidy lze využít i jako cennou zpětnou vazbu, zda je léčba SS optimálně nastavena. Významný pokles NP je známkou úspěšné terapie. Pacienti, kteří dosáhnou před propuštěním hodnot nižších než 400 ng/L u BNP nebo 1000 ng/L u NT-proBNP, mají lepší prognózu a nižší riziko rehospitalizace. Přestože nelze tyto cut-off hodnoty vnímat jako absolutní cíle pro terapii, může hladina NP pomoci při titrování léčby SS podle odborných doporučení.
3. Doporučená literatura
- Spinar, J., Hradec, J., Špinarová, L., & Vitovec, J. (2016). Summary of the 2016 ESC Guidelines on the diagnosis and treatment of acute and chronic heart failure. Prepared by the Czech Society of Cardiology. Cor et Vasa, 58(1), e530–e568. http://doi.org/10.1016/j.crvasa.2013.01.002
- Bayes-Genis, A., Lupón, J., & Jaffe, A. S. (2016). Can Natriuretic Peptides be Used to Guide Therapy? Ejifcc, 27(3), 208–216. Retrieved from http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5009945/
- Xiao, P., Li, H., Li, X., & Song, D. (2018). Analytical barriers in clinical B-type natriuretic peptide measurement and the promising analytical methods based on mass spectrometry technology.
- Skapinker, M. (2018). What Is New in Heart Failure Management in 2017? Update on ACC/AHA Heart Failure Guidelines. Current Cardiology Reports, 20(39), 14. http://doi.org/10.1007/s11886-018-0978-7
- Zhang, Z.-L., Li, R., Yang, F.-Y., & Xi, L. (2018). Natriuretic peptide family as diagnostic/prognostic biomarker and treatment modality in management of adult and geriatric patients with heart failure: remaining issues and challenges. Journal of Geriatric Cardiology : JGC, 15(8), 540–546. http://doi.org/10.11909/j.issn.1671-5411.2018.08.008
- Riddell, E., & Lenihan, D. (2018). The role of cardiac biomarkers in cardio-oncology. Current Problems in Cancer, 42, 375–385. http://doi.org/10.1016/j.currproblcancer.2018.06.012
- Ibrahim, N. E., & Januzzi, J. L. (2018). The Future of Biomarker-Guided Therapy for Heart Failure After the Guiding Evidence-Based Therapy Using Biomarker Intensified Treatment in Heart Failure (GUIDE-IT) Study. Current Heart Failure Reports, 15(2), 37–43. http://doi.org/10.1007/s11897-018-0381-0
- Kimenai, D. M., Janssen, E. B. N. J., Eggers, K. M., Lindahl, B., Den Ruijter, H. M., Bekers, O., … Meex, S. J. R. (2018). Sex-Specific Versus Overall Clinical Decision Limits for Cardiac Troponin I and T for the Diagnosis of Acute Myocardial Infarction: A Systematic Review. Clinical Chemistry, 64(7), 1034–1043. http://doi.org/10.1373/clinchem.2018.286781
- Thygesen, K., Alpert, J. S., Jaffe, A. S., Chaitman, B. R., Bax, J. J., Morrow, D. A., & White, H. D. (2018). Fourth Universal Definition of Myocardial Infarction (2018). Journal of the American College of Cardiology. http://doi.org/10.1016/j.jacc.2018.08.1038
- Roffi, M., Patrono, C., Collet, J.-P., Mueller, C., Valgimigli, M., Andreotti, F.et al. (2016). 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. European Heart Journal, 37(3), 267–315.